


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
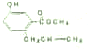
| A、A在碱性条件下不能发生水解反应 |
| B、1molA能和4mol氢气发生加成反应 |
| C、和溴水反应时,1molA能消耗1molBr2 |
| D、A不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的NaF溶液中所含F-的数目小于0.1NA |
| B、标准情况下,2.24L乙醇中含有的C-H键数目为0.5NA |
| C、0.1mol Na完全被氧化生成Na2O2,转移电子的数目为NA |
| D、0.1mol O2中含氧原子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
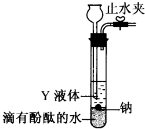
查看答案和解析>>
科目:高中化学 来源: 题型:
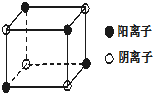 现有部分前四周期7种元素,原子序数依次增大,它们的性质或原子结构如下表:
现有部分前四周期7种元素,原子序数依次增大,它们的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| A | A原子所处的周期数、族序数都与其原子序数相等 |
| B | L层s电子数比p电子数少l |
| C | 核外电子有8种不同的运动状态 |
| D | 第三周期中的半导体材科 |
| E | 最外层电子数比次外层电子数少2个电子 |
| F | 第四周期中未成对电子数最多 |
| G | G3+核外电子有3层且M层3d轨道电子半充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述溶液能使甲基橙试剂变黄色,石蕊试液变蓝 |
| B、室温下,HCN是比NH3?H2O更弱的电解质 |
| C、上述溶液中NH4+的水解程度大于CN-的水解程度 |
| D、室温下,0.1mol/LNaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com