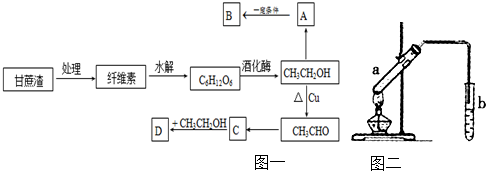
分析:(1)根据n=cV计算出硫酸铜的物质的量,再根据m=nM分别计算出需要硫酸铜固体、五水硫酸铜的质量;
(2)配制90mL溶液,需要选用100mL容量瓶,实际上配制的是100mL 0.10mol/L的硫酸铜溶液;
(3)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量
n和溶液的体积
V引起的,误差分析时,关键要看配制过程中引起
n和
V怎样的变化:若
n比理论值小,或
V比理论值大时,都会使所配溶液浓度偏小;若
n比理论值大,或
V比理论值小时,都会使所配溶液浓度偏大;
(4)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器;
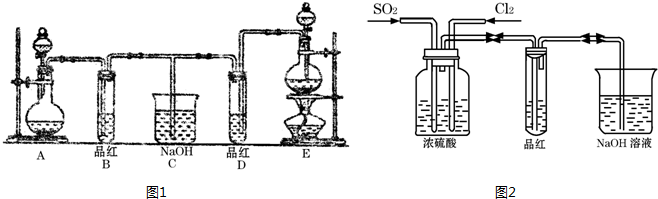
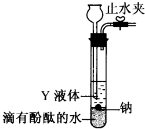
(5)①根据装置可知Y液体密度小于水,且与水不溶;
②利用注水法确定装置气密性.
解答:
解:(1)实验室没有90mL的容量瓶,应该选用100mL容量瓶,配制100mL 0.10mol/L的硫酸铜溶液,
需要硫酸铜的物质的量为:n(CuSO
4)=0.10mol/L×0.1L=0.01mol,需要五水硫酸铜的质量为:m(CuSO
4?5H
2O)=250g/mol×0.01mol=2.5g,
故答案为:2.5;
(2)实验室没有90mL的容量瓶,应该选用100mL容量瓶,配制100mL 0.1mol/L的硫酸铜溶液的操作步骤有:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,需要的仪器有:天平、药匙、玻璃棒、胶头滴管、烧杯和100mL容量瓶,故需要的玻璃仪器有:玻璃棒、胶头滴管、烧杯和100mL容量瓶,还缺100mL容量瓶,
故答案为:100mL容量瓶;
(3)①称量时将砝码放置在托盘天平左盘,由于没使用游码,无影响,故①错误;
②容量瓶洗净后未干燥,有少量蒸馏水,对溶质的物质的量和溶液的体积没有影响,所以不影响配制结果,故②错误;
③溶解时,未冷却至室温即转入容量瓶进行定容,热的溶液体积偏大,冷却后溶液体积偏小,根据c=
可得,配制的溶液浓度偏高,故③正确;
④移液时有少量液体流出容量瓶外面,会导致配制的溶液中溶质的物质的量偏小,根据c=
可得,配制的溶液浓度偏低,故④错误;
⑤定容时俯视刻度线,会导致加入的蒸馏水低于容量瓶刻度线,根据c=
可得,配制的溶液浓度偏高,故⑤正确;
⑥定容后经振荡,摇匀、静置液面下降,未经任何处理,属于正常现象,不影响配制结果,故⑥错误;
故答案为:③⑤;
(4)容量瓶作为精密仪器不可用于储存和溶解,也不能测量除其规格以外容积的液体体积,故答案为:A;
(5)①装置可知Y液体密度小于水,且与水不溶;
A.煤油密度小于水,且与水不溶,故A正确;
B.酒精与水互溶,故B错误;
C.四氯化碳密度大于水,且与水不溶,故C错误;
故选A.
②关闭止水夹,向长颈漏斗中注水,直到长颈漏斗中的液面高于试管中的液面,且两者液面差不再改变,就证明该装置气密性良好.
故答案为:关闭止水夹,向长颈漏斗中加水,若水无法下流,则气密性好.



 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案