
| ||
| ||
| ||
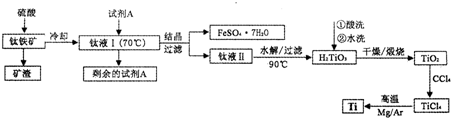


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
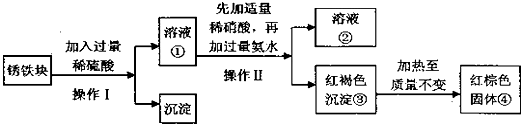
查看答案和解析>>
科目:高中化学 来源: 题型:
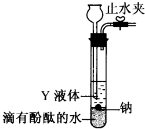
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
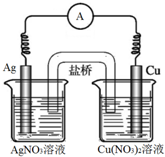 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成如下原电池,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成如下原电池,有关叙述正确的是( )| A、向硝酸银溶液中加入氯化钠固体,电流强度会减小 |
| B、向硝酸铜溶液中加入氢氧化钠固体,电流强度会减小 |
| C、将AgNO3溶液更换为Fe(NO3)3溶液,电流计指针偏转方向将相反 |
| D、当电流计指针为0时,该反应平衡常数K=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
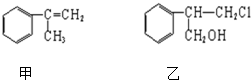
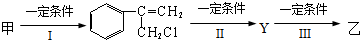
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.2 mol |
| B、1.5 mol |
| C、1.8 mol |
| D、2.5m ol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com