
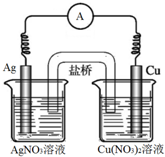
 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成如下原电池,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成如下原电池,有关叙述正确的是( )| A、向硝酸银溶液中加入氯化钠固体,电流强度会减小 |
| B、向硝酸铜溶液中加入氢氧化钠固体,电流强度会减小 |
| C、将AgNO3溶液更换为Fe(NO3)3溶液,电流计指针偏转方向将相反 |
| D、当电流计指针为0时,该反应平衡常数K=0 |
| [Ag+]2 |
| [Cu2+] |
| [Ag+]2 |
| [Cu2+] |
| [Ag+]2 |
| [Cu2+] |
| [Ag+]2 |
| [Cu2+] |
| [Cu2+] |
| [Ag+]2 |
| [Ag+]2 |
| [Cu2+] |
| [Ag+]2 |
| [Cu2+] |
| [Ag+]2 |
| [Cu2+] |
| [Ag+]2 |
| [Cu2+] |


科目:高中化学 来源: 题型:
| A、Mg+、Na+、Cl-、NO3- |
| B、OH-、CO32-、Cl-、K+ |
| C、Cu2+、NO3-、OH-、Cl- |
| D、Ba2+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
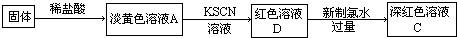
| 实验操作 | 预期现象 | 结论 |
| 取少量褪色后的溶液, | 说明假设一是合理的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、某溶液
| ||
B、某溶液
| ||
C、某溶液
| ||
D、某溶液
|
查看答案和解析>>
科目:高中化学 来源: 题型:

 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com