
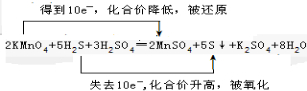
 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| A、采用加热蒸干高锰酸钾溶液的方法获得高锰酸钾晶体 |
| B、过滤时,为了加快过滤速率,可用玻璃棒在漏斗内搅拌 |
| C、某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 |
| D、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲酸的结构简式:HO-CHO |
B、一氟甲烷电子式: |
| C、聚丙烯的最简式:CH2 |
| D、次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为wmol/L,放出热量Q2kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为wmol/L,放出热量Q2kJ.查看答案和解析>>
科目:高中化学 来源: 题型:

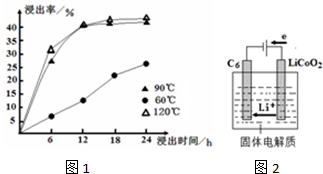
| c(Ca2+) |
| c(Mg2+) |
| ||
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
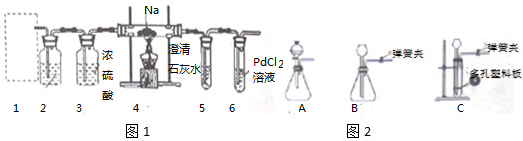
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com