
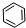
 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有
| 1 |
| 2 |
| m |
| ρ |
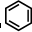 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |
| m |
| ρ |
| ||
| a |
| 312 |
| aNA |
| 312 |
| aNA |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、KCl溶液在电流作用下电离成K+和Cl- |
| B、SO2溶于水能部分转化成离子,故SO2属于弱电解质 |
| C、CaSO4微溶于水,所以CaSO4属弱电解质 |
| D、同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、人们使用
| ||||
| B、科学家们在过渡元素中寻找催化剂 | ||||
| C、目前周期表中的所有元素都是科学家们从自然界发现的 | ||||
| D、只有主族元素同时由短周期元素和长周期元素共同构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(F-) |
| c(H+) |
| A、afh | B、acg |
| C、cf | D、bdh |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
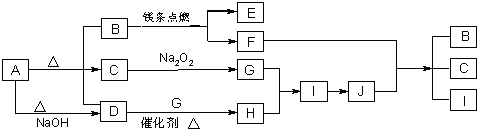
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
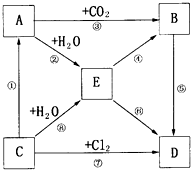 如图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.
如图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com