
【题目】以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO等杂质)为主要原料生产二水合重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下图所示。

回答下列问题:
(1)二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为________________。
(2)已知:步骤①中涉及的主要反应是FeO·Cr2O3+Na2CO3+O2![]() Na2CrO4+Fe2O3+CO3(未配平),该反应中氧化剂和还原剂的物质的量比为_____________。
Na2CrO4+Fe2O3+CO3(未配平),该反应中氧化剂和还原剂的物质的量比为_____________。
(3)滤渣1的主要成分为MgO和_____(填化学式);滤渣2的成分是______(填物质名称)。
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和Na2SO4的混合溶液,发生反应的离子方程式为_______________。
(5)经步骤④酸化后的溶液中获得Na2Cr2O7·2H2O晶体的操作依次是蒸发浓缩、____、过滤、洗涤、干燥。
(6)该工艺的酸性废液中含有Cr2O72-,可向废液中加入绿矾(FeSO4·7H2O)还原处理。若处理20m3的Cr2O72-酸性废液,需要绿矾166.8g,则原废液中Cr2O72-的物质的量浓度为_____mol/L。
【答案】 +6 7 :4 Fe2O3 Al(OH)3 2H++2CrO42-![]() 2H2O + Cr2O72- 冷却结晶 5×10-6
2H2O + Cr2O72- 冷却结晶 5×10-6
【解析】(1)根据化合物中正负化合价之和为0,可得Cr的化合价为+6价。
(2)FeO·Cr2O3+Na2CO3+O2→Na2CrO4+Fe2O3+CO2,其中O2作氧化剂,每1molO2转移4mol电子,FeO·Cr2O3中Fe元素由+2价升高到+3价,Cr元素由+3价升高到+6价,则FeO·Cr2O3作还原剂,每1molFeO·Cr2O3转移7mol电子,所以该反应中氧化剂和还原剂的物质的量比为7:4。
(3)流程分析:流程目的为生产Na2Cr2O7·2H2O,所以要先除去原料中的Mg、Al、Fe。第①步氧化煅烧,FeO·Cr2O3+Na2CO3+O2→Na2CrO4+Fe2O3+CO2,Al2O3+Na2CO3→NaAlO2+CO2,MgO不反应,煅烧后所得固体主要为Na2CrO4、Fe2O3、MgO和NaAlO2。第②步,水浸后,不溶于水的MgO、Fe2O3进入滤渣1,Na2CrO4和NaAlO2进入滤液。第③步,调节pH将AlO2-转化为Al(OH)3除去,得到Na2CrO4溶液。第④步,加入稀硫酸酸化,将CrO42-转化为Cr2O72-。根据上述分析,滤渣1的主要成分为MgO和Fe2O3;滤渣2的成分是Al(OH)3。
(4)步骤③所得滤液主要成分为Na2CrO4,加入稀硫酸,反应生成Na2Cr2O7和Na2SO4,溶液由黄色变化橙色,即CrO42-转化为Cr2O72-。该反应是非氧化还原反应,只需要根据电荷守恒和原子守恒即可写出此反应的离子方程式:2H++2CrO42-2H2O+Cr2O72- 。
(5)从Na2Cr2O7溶液中获得Na2Cr2O7·2H2O晶体,为防止失去结晶水,应采取冷却结晶的方式,操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。故答案为冷却结晶。
(6)Cr2O72-具有强氧化性,作氧化剂,化合价降低生成Cr3+,每反应1molCr2O72-,得到6mol电子;FeSO4·7H2O具有还原性,作还原剂,化合价升高生成Fe3+,每反应1mol FeSO4·7H2O转移1mol电子,则有n(Cr2O72-)=n(FeSO4·7H2O)×![]() 。n(FeSO4·7H2O)=
。n(FeSO4·7H2O)= ![]() =0.6mol,所以n(Cr2O72-)=0.1mol。c(Cr2O72-)=0.1mol÷(20×103L)=5×10-6mol/L.
=0.6mol,所以n(Cr2O72-)=0.1mol。c(Cr2O72-)=0.1mol÷(20×103L)=5×10-6mol/L.


科目:高中化学 来源: 题型:
【题目】学习化学有利于我们认识饮食与健康的关系,养成良好的饮食习惯.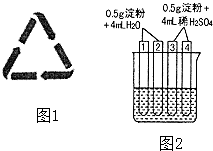
(1)油脂被摄人人体后,在酶的作用下水解为(写名称,下同)和 , 进而被氧化生成并提供能量,或作为合成人体所需其他物质的原料.
(2)发育出现障碍,患营养缺乏症,这主要是由于摄取(填“蛋白质”、“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是 (填字母).
A菠菜 B花生油 C瘦肉 D西瓜
(3)某火腿制品的包装上印有相关配料:精选瘦肉、白糖、淀粉、亚硝酸钠等.火腿中属于防腐剂的是 , 不可长期或大量进食腌制肉类食品的原因是:其包装袋上常可看到如图1所示的图标,它的含义是 , 此包装袋材料是聚乙烯塑料,它的单体是(填结构简式).
(4)如图2所示4支试管同时水浴加热4min.为检验其中淀粉的水解程度,某同学的实验操
作与现象记录如下:
试管 | 操作 | 现象 |
① | 加入碘水 | 溶液变成蓝色 |
② | 加入银氨溶液,水浴加热 | 未出现银镜 |
③ | 加入碘水 | 溶液变成蓝色 |
④ | 加入银氨溶液,水浴加热 | 未出现银镜 |
①结合试管1、2中的现象,得出的结论是:这两支试管中淀粉水解(填“没有”、“部分”或“全部”),淀粉 (填“有”或“没有”)还原性.
②结合试管3、4中的现象,(填“能”或“不能”)得出“这两支试管中淀粉没有水解”的结论,理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4 7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH 为3.0,沉淀完全时的pH为5.5:
回答下列问题:
(1)操作Ⅱ中用硫酸酸化至pH=2且通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②;
(2)操作IV的顺序依次为:、、过滤、洗涤。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②。
(4)测定绿矾产品中Fe2+ 含量的方法是:a.称取8.680g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.02000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为30.00 mL(滴定时发生反应的离子方程式为:5Fe2+ + MnO4- + 8H+ ═ 5Fe3+ + Mn2+ + 4H2O)
①计算上述样品中FeSO4 7H2O的质量分数为(结果保留4位有效数字,FeSO4 7H2O的摩尔质量为278g/mol)
②若用上述方法测定的样品中FeSO47H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有:样品中存在少量的杂质、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.0lmol/L CH3COOH 溶液中逐滴加入0.01mol/L的NaOH溶液,溶液中水电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是
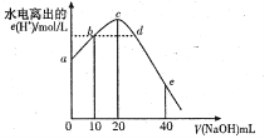
A. 从a到c,醋酸的电离始终受到促进
B. b、d两点溶液的pH相同
C. c点所示溶液中c(Na+)>c(CH3COO- )>c(OH- )>c(H+ )
D. e 点所示溶液中,c(Na+)=2c(CH3COO- )+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏移的是( )
A.CCl4 B.C2H5OH C.CS2 D.C6H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂,目前已开发出用电解法制取ClO2的新工艺.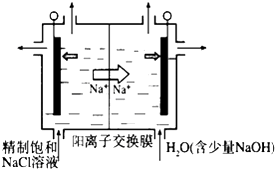
(1)①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式: .
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为mol;用平衡移动原理解释阴极区pH增大的原因。
(2)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN-amg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为;处理100m3这种污水,至少需要ClO2mol.
(3)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com