
【题目】已知A、B、C、D、E、F、G、H、I是中学化学中常见的九种化合物,其中B常温下为无色无味透明的液体,C焰色反应火焰呈黄色,E是红棕色的固体;X、Y是两种常见的单质,其中X常温常压下为气体。

根据上面框图关系填空。
(1)A的化学式为________________,固体A的颜色为__________________;
(2)写出“X+F![]() G+B”的化学反应方程式________________________;
G+B”的化学反应方程式________________________;
(3)写出“实验室中制取F气体”的化学反应方程式_____________________;
(4)写出“C→D”反应的离子方程式_________________________;
(5)写出“E+金属单质![]() Y+两性氧化物”的化学反应方程式___________________。
Y+两性氧化物”的化学反应方程式___________________。
【答案】
(1)Na2O2;淡黄色
(2)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(3)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(4)Fe3++3OH-==Fe(OH)3↓
(5)2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
【解析】
试题分析:已知A、B、C、D、E、F、G、H、I是中学化学中常见的九种化合物,其中B常温下为无色无味透明的液体,B为水,C焰色反应火焰呈黄色,C中含有钠元素,E是红棕色的固体,E是氧化铁;固体A能够与水反应生成C和X,X常温常压下为气体单质,则A Na2O2,X为氧气,C为氢氧化钠,根据(5)“E+金属单质![]() Y +两性氧化物”,可知金属单质是铝,Y是铁,则D为氢氧化铁,X+F
Y +两性氧化物”,可知金属单质是铝,Y是铁,则D为氢氧化铁,X+F![]() G+B,则F为氨气,G为NO,H为NO2,I为硝酸。
G+B,则F为氨气,G为NO,H为NO2,I为硝酸。
(1)根据上述分析,A的化学式为Na2O2,固体A的颜色为淡黄色,故答案为:Na2O2;淡黄色;
(2)“X+F![]() G+B”的化学反应方程式为4NH3+5O2
G+B”的化学反应方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)实验室中制取氨气的化学反应方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(4)C→D反应的离子方程式为Fe3++3OH-==Fe(OH)3↓;
(5)“E+金属单质![]() Y+两性氧化物”的化学反应方程式为2Al+Fe2O3
Y+两性氧化物”的化学反应方程式为2Al+Fe2O3![]() Al2O3+2Fe。
Al2O3+2Fe。


科目:高中化学 来源: 题型:
【题目】(1)合成氨反应的热化学方程式:N2(g)+3H2(g)=2NH3(g)ΔH=-92.2 kJ·mol-1
已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,则在反应混合物中要投放N2的物质的量的取值范围为________mol。
(2)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:负极的电极反应式:__________,正极的电极反应式:__________。
(3)如图是一个电解过程示意图。
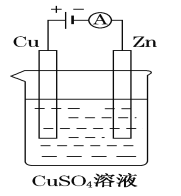
锌片上发生的电极反应式是:_______________
②假设使用肼-空气燃料电池作为该过程中的电源,锌片质量变化为64 g,则肼-空气燃料电池理论上消耗标准状况下的空气__________L(假设空气中氧气体积分数为20%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学平衡常数K的叙述正确的是( )
A. K越大,表示化学反应速率越大
B. 对任一可逆反应,温度升高,则K值增大。
C. 加入催化剂或增大反应物的浓度时,K值就增大
D. 对任一可逆反应,K越大,表示反应物的转化率越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一个12C原子质量为ag, 有一种X原子的质量为bg.设NA为阿伏伽德罗常数,则X的相对原子质量可表示为:
(2)现有下列物质:①氢氧化钾固体 ②稀硫酸 ③铜片 ④蔗糖 (C12H22O11) 固体 ⑤熔融的氯化钠。
用以上物质的序号填空:属于电解质的是_______________,属于非电解质的是____________;所给状态下能够导电的是______________。
(3)反应(未配平):BrF3+H2O-Br2+O2+HBrO3+HF已知生成物中Br2与O2的物质的量之比为1:1。则:
①配平后H2O 与HF物质的量之比为 ;
②还原剂为 ;
③如有5molH2O参加反应则参加氧化还原反应的H2O物质的量为 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH3,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是
A.1mol NH3中含5NA个N-H键(NA表示阿伏加德罗常数)
B.NH3中既有共价键又有离子键
C.NH5的电子式为![]()
D.它与水反应的离子方程式为NH4++H2O![]() NH3·H2O+H2↑
NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下, CH4与 H2O(g)发生反应: CH4(g) + H2O(g)=CO(g) + 3H2(g)。设起始n(H2O)/n(CH4)=Z,在恒压下,平衡时 CH4的体积分数 φ(CH4)与Z和 T(温度)的关系如右图所示,下列说法正确的是

A.该反应的焓变△H>0
B.图中 Z 的大小为 a>3>b
C.图中 X 点对应的平衡混合物中 n(H2O)/n(CH4)=3
D.温度不变时,图中 X点对应的平衡在加压后 φ(CH4)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com