
【题目】在一定条件下可实现下图所示物质之间的转化:
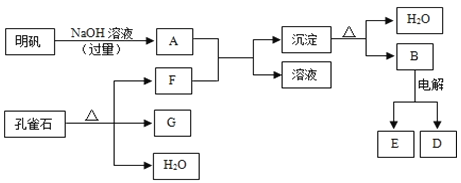
注意:①明矾(KAl(SO4)2·12H2O),可以电离出K+,Al3+,SO42-
②G是黑色固体,D是金属单质,E是常见的双原子气体分子
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是______(填化学式)。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:________________。
(3)写出B电解生成E和D的反应方程式:________________。
(4)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式______,该反应消耗了2 molG,则转移的电子数是____________。
【答案】 CO2 Al3++4OH-=AlO2-+2H2O 2Al2O3![]() 4Al+3O2↑ 2Al+3CuO
4Al+3O2↑ 2Al+3CuO![]() Al2O3+3Cu 4mol
Al2O3+3Cu 4mol
【解析】孔雀石的主要成分是CuCO3Cu(OH)2(碱式碳酸铜),受热易分解的产物为氧化铜、水、二氧化碳,明矾的主要成分是KAl(SO4)212H2O,其中的铝离子能和过量NaOH溶液反应生成偏铝酸钠水溶液,所以A为:NaAlO2,碱式碳酸铜受热易分解的产物中,只有二氧化碳可以和A反应,所以F为CO2,G为氧化铜,B为氢氧化铝受热分解的产物,则B为氧化铝,电解熔融氧化铝生成铝和氧气,(1)由上述分析可知F为CO2;(2)明矾溶液与过量NaOH溶液反应的实质是:铝离子和氢氧根之间的反应,离子方程式为:Al3++4OH-=AlO2-+2H2O;(3)氧化铝电解生成铝和氧气的反应方程式为:2Al2O3![]() 4Al+3O2↑;(3)偏铝酸钠和CO2反应生成氢氧化铝,氢氧化铝分解生成氧化铝和水。电解氧化铝生成氧气和铝单质。由于D是固体,所以E是氧气,D是铝。铝和氧化铜发生铝热反应,方程式为2Al+3CuO
4Al+3O2↑;(3)偏铝酸钠和CO2反应生成氢氧化铝,氢氧化铝分解生成氧化铝和水。电解氧化铝生成氧气和铝单质。由于D是固体,所以E是氧气,D是铝。铝和氧化铜发生铝热反应,方程式为2Al+3CuO![]() Al2O3+3Cu;根据反应方程式可知,若反应消耗了2 molG(氧化铜),则转移的电子数是4mol。
Al2O3+3Cu;根据反应方程式可知,若反应消耗了2 molG(氧化铜),则转移的电子数是4mol。


科目:高中化学 来源: 题型:
【题目】合理膳食、合理用药是人体健康的需要.
①下列营养素中,不能对人体提供能量的是(填字母).
a.维生素 b.糖类 c.蛋白质
②某肉制品包装上印有相关配料如图所示.
其中属于调味剂的是;属于发色剂的是;
属于防腐剂的是 .
③当体内胃酸分泌过多时,医生会建议服用以下常用药物中的(填字母).
a.阿司匹林 b.青霉素片 c.复方氢氧化铝片 d.合成抗菌药.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学。
(1)近年频繁发生的有关化学品泄漏或爆炸事件一次次给我们敲响了安全警钟,操作不当就会存在安全隐患。下列做法正确的是_______________。
①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌;
②酒精、钠等着火,可以用水扑灭;
③如果发生氯气泄露,可用沾Na2CO3溶液的湿毛巾捂住口鼻,向上风口或地势高的地方撤离;
④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏原因,并打开所有门窗通风;
⑤不慎将浓硫酸沾到皮肤上,要立即用干布拭去,再用大量水冲洗,然后涂上NaOH溶液;
⑥加热液体的试管口不能对着自己或别人;
⑦实验中当有少量的过氧化钠或金属钠剩余时,用纸包裹好后将其放入垃圾桶中
(2)某同学需要配制0.1mol·L-1 的NaHCO3溶液500mL,请根据溶液配制过程中的情况回答下列问题:
①应称取固体NaHCO3的质量为____________________。
②实验中除了托盘天平(带砝码和镊子)、烧杯、药匙、玻璃棒外还需要的其它仪器有_________________________
③定容观察液面时俯视刻度线,所配溶液浓度_______(填“偏高”、“偏低”或“无影响”)
④所配的NaHCO3溶液在保存时,常因温度过高而分解,含有少量Na2CO3,若要除去杂质Na2CO3,最简便的方法是_______,其反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于淀粉和纤维素的叙述,正确的是( )
A.因为都属于糖,所以都具有甜味
B.人体内有催化淀粉和纤维素水解的酶
C.两者都能在一定条件下水解生成葡萄糖
D.因为二者都是由多个单糖分子按照一定的方式在分子间脱水结合而成,所以都用(C6H10O5)n表示,因此它们是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中发生如下反应:PCl5(g)═PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 | 平衡物质的量 | 达到平衡所需时间 | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是( )
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol/(Ls)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应同时又是吸热反应的是
A.Ba(OH)2·8H2O与NH4Cl反应B.铝热反应
C.H2与O2的燃烧反应D.灼热的炭与CuO反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是大气污染物之一,主要来源于工业烟气及汽车尾气等。除去NOx的方法统称为脱硝,一般有干法脱硝[选择性催化剂法(SCR)]、湿法脱硝等。
请完成下列问题:
(1)汽车发动机工作时会引发反应N2(g)+O2(g)![]() 2NO(g)。2000 K 时,向固定容积的密闭容器中充入等物质的量的N2、O2 发生上述反应,各组分体积分数(φ)的变化如图1所示。N2 的平衡转化率为_____________。
2NO(g)。2000 K 时,向固定容积的密闭容器中充入等物质的量的N2、O2 发生上述反应,各组分体积分数(φ)的变化如图1所示。N2 的平衡转化率为_____________。

(2)在密闭、固定容积的容器中,一定量NO发生分解的过程中,NO 的转化率随时间变化关系如图2 所示。
①反应2NO(g)![]() N2(g)+O2(g) △H_______0 (填“>”或“<” )。
N2(g)+O2(g) △H_______0 (填“>”或“<” )。
②一定温度下,能够说明反应2NO(g)![]() N2(g)+O2(g)已达到化学平衡的________(填序号)。a.容器内的压强不发生变化 b.混合气体的密度不发生变化
N2(g)+O2(g)已达到化学平衡的________(填序号)。a.容器内的压强不发生变化 b.混合气体的密度不发生变化
C.NO、N2、O2 的浓度保持不变 d.2v(NO)正=v(N2 )逆
(3)干法脱硝:SCR(选择性催化剂法)技术可有效降低柴油发动机在空气过量条件下的NO 排放。其工作原理如下:

①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式为____________。
②反应器中NH3 还原NO 的化学方程式为____________________。
(4)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①NaClO2 溶液显碱性,用离子方程式解释原因_______________________。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块生物组织或结构捣碎后进行化学分析,得知其中含有水、蛋白质、DNA和糖原等成分,由此可判断该组织或结构是 ( )
A.SARS病毒 B.家兔的肝脏 C.甜菜的块根 D.细菌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com