
下图①—⑩分别代表有关反应中的一种物质,其中③气体能使酚酞试液变红,⑦是红综色气体,回答: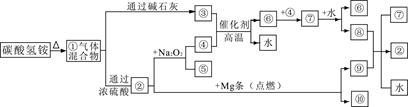
(1)①中的混合气体通过浓硫酸发生化学反应,主要生成物的化学式是 。
(2)写出碳酸氢铵中阳离子的检验方法 。
(3)写出工业上合成③的化学方程式 。
(4)⑧与⑨反应的化学方程式是 。
(1)(NH4)2SO4
(2)取少量样品放入试管配成溶液,加入浓的氢氧化钠溶液微热,在试管口放一片湿润的红色石蕊试纸,若试纸变蓝则含有氨根离子。
(3)N2 + 3H2 2NH3
2NH3
(4)C + 4HNO3(浓)  CO2↑+ 4NO2↑ + 2 H2O
CO2↑+ 4NO2↑ + 2 H2O
解析试题分析:分析题意,③使酚酞试液变红,③为氨气;⑦是红综色气体,⑦是二氧化氮气体。(1)碳酸氢铵分解的气体产物有氨气、二氧化碳、水,氨气被硫酸吸收主要得硫酸铵,化学式为(NH4)2SO4
(2)碳酸氢铵中的阳离子是铵根离子,其检验方法为取少量样品放入试管配成溶液,加入浓的氢氧化钠溶液微热,在试管口放一片湿润的红色石蕊试纸,若试纸变蓝则含有氨根离子。
(3)碳酸氢铵的分解产物被碱石灰吸收后余氨气,所以工业上合成氨气的化学方程式N2 + 3H2 2NH3
2NH3
(4)⑦是二氧化氮,则⑧是硝酸;①的混合气体产物被浓硫酸吸收后余二氧化碳,二氧化碳与镁反应生成碳单质,所以⑧与⑨反应是碳和浓硝酸的反应,化学方程式为C + 4HNO3(浓) CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
考点:考查物质推断、铵根离子的检验、化学方程式的书写、化学式的判断


科目:高中化学 来源: 题型:填空题
硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是 。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有 。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: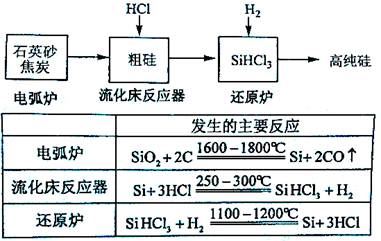
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为 ;碳化硅又称 ,其晶体结构与 相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 。
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请回答下列实验室中制取气体的有关问题。
(1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。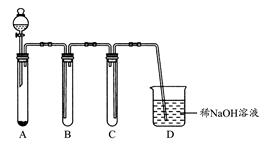
装置B,C,D的作用分别是:B ;C ;D 。
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是 (填序号);
②根据所选的装置完成下表;(不需要的可不填)
| | 应加入的物质 | 所起的作用 |
| A | | |
| B | | |
| C | | |
| D | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl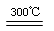 SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):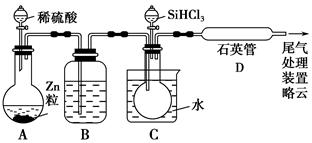
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________,装置D中发生反应的化学方程式为_____________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请从图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。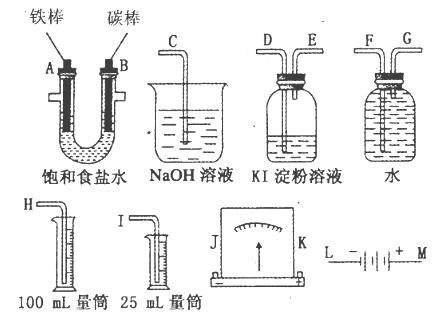
(1)A极发生的电极反应式是_____________________·B极发生的电极反应式是_______________________;电解饱和食盐水的化学方程式是______________________。
(2)电源的M端应连接的电极为____________(A或B)极。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:______________________________
__________________________________(填接口编号)。
(4)实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为________________。
(5)已知饱和食盐水50mL,某时刻测得H2体积为56mL(标准状况)。此时溶液pH约为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅及其化合物对人类现代文明具有特殊贡献,请回答下列有关问题:
(1)硅原子的结构示意图:________。
(2)下列物品或设备所用的材料属于硅酸盐的是________。
①长江三峡水泥大坝;②石英光导纤维;③陶瓷坩埚;④普通玻璃;⑤硅太阳能电池
A.①②③ B.③④⑤ C.②③④ D.①③④
(3)常温下,SiCl4为液态,沸点为57.6℃,在空气中冒白雾。制备高纯度硅的中间产物SiCl4中溶有液态杂质,若要得到高纯度SiCl4,应采用的方法是________;用化学方程式及必要文字解释SiCl4在空气中冒白雾的原因:_______________________________________。
(4)工业上可用SiCl4(g)制备高温结构陶瓷氮化硅,其反应方程式为
3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)
Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)
①该反应的平衡常数表达式K=______________.
②在密闭恒容容器中,能表示上述反应达到平衡状态的是________。
A.3v逆(N2)=v正(H2)
B.v正(HCl=4v正=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6
③在某条件下达到平衡时,H2与HCl物质的量之比为m∶n;保持其他条件不变,降低温度达到平衡时,H2与HCl物质的量之比________m∶n(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流等等。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 (可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水,有刺激性气味,对人的呼吸系统有损伤,可与碱发生作用。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
(1)写出电解时发生反应的化学方程式 ;
(2)除去ClO2中的NH3可选用的试剂是 (填序号);
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL足量硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收(假设吸收完全);将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2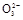
 2I-+S4
2I-+S4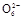 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。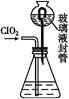
①装置中玻璃液封管的作用是 ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨气既是一种工业产品,也是一种重要的工业原料。在工农业生产中具有广泛的用途。
(1)工业合成氨是在________(填工业设备名称)中完成的,某合成氨工厂一天中通入的N2为20 t,通入的H2为3 t,那么这一天生产的NH3可能为________t。
a.23 b.24.3 c.17 d.6
(2)合成氨的原料气氮气来自大气,工业上从空气中分离出氮气的方法有物理方法和化学方法。物理方法是________,化学方法是___________________。
(3)合成氨的原料气氢气主要来自煤的气化,气化过程中除得到氢气外,还得到另外一种燃料气,这种燃料气的化学式为________。
(4)我国化学家侯德榜改革国外的纯碱生产工艺,发明了“侯氏制碱法”。该法制碱是向饱和食盐水中通入NH3和CO2,在实际工业生产中,这两种气体的通入顺序是________,“侯氏制碱法”的副产品可作农业生产的化肥,该副产品是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
______________________________________________________________。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。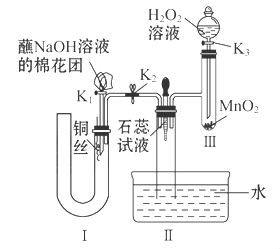
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象是____________________________________________________。
②装置Ⅲ中发生反应的化学方程式为_______________________________。
③蘸NaOH溶液的棉花团的作用是___________________________________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com