
【题目】能源问题日益成为制约国际社会经济发展的瓶颈.甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图.
请回答下列问题: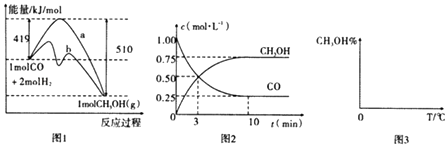
(1)在“图1”中,曲线(填“a”或“b”)表示使用了催化剂;该反应属于(填“吸热”或“放热”)反应.
(2)根据“图2”判断,下列说法不正确的是 .
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1mol CO和2mol H2 , 再次达到平衡时 ![]() 会增大
会增大
(3)从反应开始到建立平衡,v(H2)=;该温度下CO(g)+2H2(g)CH3OH(g)的化学平衡常数为 . 若保持其他条件不变,向平衡体系中再充入0.5mol CO、1molH2、1.5molCH3OH,此反应进行的方向为(填“正反应方向”或“逆反应方向)”.
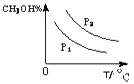
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出p1、p2 , 且p1>p2).
【答案】
(1)b;放热
(2)AB
(3)0.15mol?L﹣1?min﹣1;12L2?mol﹣2;平衡不移动
(4)解:CO(g)+2H2(g)CH3OH(g)△H<0,
则温度越高,逆向反应进行的程度越大,甲醇的含量就越低,
压强增大,反应正向进行的程度大,则甲醇的含量高,则图象为
【解析】解:(1)加入催化剂,可降低反应的活化能,由图象可知b活化能较低,应加入催化剂,反应物的总能量大于生成物的总能量,则反应为放热反应,所以答案是:b;放热;(2)A、由图2可知生成0.75mol/LCH3OH,则反应了0.75mol/LCO,平衡时有0.25mol/LCO,即CO的起始物质的量为(0.75mol/l+0.25mol/L)×2L=2mol,故A错误;
B、增加CO浓度,会促进氢气的转化,氢气的转化率增大,但CO的转化率减小,故B错误;
C、该反应为反应前后压强不等的反应,则压强不变时,该反应达到平衡状态,故C正确;
D、再充入1molCO和2molH2 , 体积不变,则压强增大,平衡正向移动,再次达到平衡时 ![]() 会增大,故D正确;
会增大,故D正确;
所以答案是:AB;(3)由图2可知,反应中减小的CO的浓度为1mol/L﹣0.25mol/L=0.75mol/L,10min时达到平衡,
则用CO表示的化学反应速率为 ![]() =0.075molL﹣1min﹣1 ,
=0.075molL﹣1min﹣1 ,
因反应速率之比等于化学计量数之比,则v(H2)=0.075molL﹣1min﹣1×2=0.15molL﹣1min﹣1;
CO(g)+ | 2H2(g) | CH3OH(g) | ||
开始(mol/L) | 1 | 2 | 0 | |
转化(mol/L) | 0.75 | 1.5 | 0.75 | |
平衡(mol/L) | 0.25 | 0.5 | 0.75 |
则化学平衡常数K═ ![]() =12L2mol﹣2;
=12L2mol﹣2;
Qc= 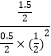 =12=K,达平衡状态,平衡不移动;
=12=K,达平衡状态,平衡不移动;
所以答案是:0.15molL﹣1min﹣1;12L2mol﹣2; 平衡不移动;
【考点精析】通过灵活运用化学平衡状态的判断和化学平衡的计算,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
A. l mol OH﹣所含电子数为10NA
B. 2L0.5 molL﹣1Na2SO4溶液中阴离子所带电荷数为0.2NA
C. 标准状况下,1.12 L CC14含有的氯原子数为0.2NA
D. 14 g由CO和N2组成的混合气体中含有的分子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在溶液中可以大量共存的是( )
A. H+、Na+、NO3-、OH-B. Na+、K+、NO3-、Cl-
C. Ca2+、K+、AlO2-、CO32-D. Ba2+、NH4+、HCO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.高级脂肪酸甘油酯属于有机高分子化合物
B.紫外线、高温、酒精可杀菌消毒的原理是蛋白质变性
C.塑料、合成纤维、合成橡胶称为三大合成高分子材料
D.维生素C又称抗坏血酸,新鲜蔬菜中富含维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学中常见的单质,D为地壳中含量最多的金属;甲、乙、丙为化合物,其中甲为有磁性的黑色晶体,乙在常温常压下为无色液体.各物质的转化关系如下: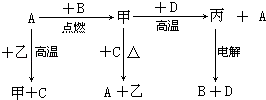
(1)组成D的元素在周期表中的位置是 .
(2)若用一种反应类型概括上述转化中所涉及到的全部反应,该反应类型是 .
(3)在上述电解反应中,阳极的极反应式是 .
(4)甲和D反应的化学方程式是 .
(5)D的某种盐常用于净水,用离子方程式表示其净水原理 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果Fe3+、SO42-、Al3+和M四种离子以物质的量之比为2∶4∶1∶1共同存在于同一种溶液中,那么M可能是 ( )
A. Na+ B. PO43- C. CO32- D. Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体),下列分析或结果错误的是

A. 原混合酸中HNO3的物质的量为0.1 mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+ == 3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+ , 如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变成Fe3+ , 生成高铁血红蛋白而丧失与O2结合的能力,服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有()。
A.酸性
B.碱性
C.氧化性
D.还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com