
����Ŀ�������£�������Һ����Ũ�ȹ�ϵһ����ȷ����
A. 0.1molLNa2CO3��Һ����ˮϡ�ͣ�c(HCO3-)/c(CO32-)��С
B. pH=7�İ�ˮ���Ȼ����Ļ����Һ��:c(Cl-)>c(NH4+)
C. 0.1molL����������Һ��:c(SO42-)>c(Al3+)>c(H+)>c(OH-)
D. pH=2�Ĵ�����Һ��pH=12��NaOH��Һ��������:c(Na+)=c(CH3COO-)+c(CH3COOH)
���𰸡�C
��������A. Na2CO3��Һ�д���̼������ӵ�ˮ��ƽ�⣬CO32����H2O![]() HCO3����OH����
HCO3����OH����![]() =
=![]() ����ˮϡ�ͣ��ٽ�ˮ�⣬��Һ�ļ��Լ�������ˮ��ƽ�ⳣ�����䣬���
����ˮϡ�ͣ��ٽ�ˮ�⣬��Һ�ļ��Լ�������ˮ��ƽ�ⳣ�����䣬���![]() ����A����B����ˮ���Ȼ�淋Ļ����Һ���ڵ���غ㣺c(OH-)+c(Cl-)=c(NH4+)+c(H+)�������£����ҺpH=7����c(OH-)=c(H+)������c(Cl-)=c(NH4+)����B����C.��������Һ��������ˮ�⣬��Һ�����ԣ���c(SO42-)>c(Al3+)>c(H+)>c(OH-)����C��ȷ��D.pH=2�Ĵ�����Һ�д����Ũ�ȴ��ں�pH=12��NaOH��Һ�������Ũ�ȴ����������Ƶ�Ũ�ȣ��������Ϻ���������c(Na+)��c(CH3COO-)+c(CH3COOH)����D����ѡC��
����A����B����ˮ���Ȼ�淋Ļ����Һ���ڵ���غ㣺c(OH-)+c(Cl-)=c(NH4+)+c(H+)�������£����ҺpH=7����c(OH-)=c(H+)������c(Cl-)=c(NH4+)����B����C.��������Һ��������ˮ�⣬��Һ�����ԣ���c(SO42-)>c(Al3+)>c(H+)>c(OH-)����C��ȷ��D.pH=2�Ĵ�����Һ�д����Ũ�ȴ��ں�pH=12��NaOH��Һ�������Ũ�ȴ����������Ƶ�Ũ�ȣ��������Ϻ���������c(Na+)��c(CH3COO-)+c(CH3COOH)����D����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵���������

A. 256gS8����(��ͼ)�к�S-S��Ϊ7NA��
B. 1molNa��O2��ȫ��Ӧ������Na2O��Na2O2�Ļ���ת�Ƶ�������ΪNA��
C. ��1molCH3COONa������CH3COOH�γɵ�������Һ�У�CH3COO-��ĿΪNA��
D. һ�������£�2mo1SO2��1molO2������ܱ������г�ַ�Ӧ�������еķ���������2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��Ũ����ķ�Ӧ�У����ת��0.4mol���ӣ���ԭ���������ʵ���
A. 0.4mol B. 0.2mol
C. ��0.4mol D. ��0.2 mol
���𰸡�B
��������
ͭ��Ũ����ķ�Ӧ�У�ͭԪ�ػ��ϼ����ߣ�ʧȥ���ӣ���Ԫ�ػ��ϼ۽��ͣ��õ����ӣ���ʧ������������ȵģ���Ϊ0.4mol��
Cu��Ũ���ᷴӦ����ʽΪCu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O���ɷ���ʽ��֪��1mol���ᱻ��ԭʱת�Ƶ������ʵ���=1mol����6-4��=2mol�������������ת��0.4mol����ԭ����������ʵ���0.2mol����ѡB��
CuSO4+SO2��+2H2O���ɷ���ʽ��֪��1mol���ᱻ��ԭʱת�Ƶ������ʵ���=1mol����6-4��=2mol�������������ת��0.4mol����ԭ����������ʵ���0.2mol����ѡB��
���㾦��
���⿼��������ԭ��Ӧ�ļ��㣬���ؿ����������������֪������������Ũ�����ת�Ƶ��ӵĹ�ϵ����ȷŨ����������ǽⱾ��ؼ���
�����͡���ѡ��
��������
18
����Ŀ���������ӷ���ʽ��д��ȷ����
A. ��Fe(OH)3�������Fe(OH)3+3H+��Fe3++3H2O
B. NH4HSO3��Һ��������NaOH��Һ��ϼ��ȣ�NH4����HSO3����2OH��![]() NH3����SO32����2H2O
NH3����SO32����2H2O
C. ����������KIO3��Һ��KI��Һ������Ӧ����I2��IO3����5I����3H2O��3I2��6OH��
D. ��FeO�м���ϡ������2FeO + 8H+ + SO42�� =2Fe3+ + SO2 ��+ 4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƻ���ᣨPMLA������ΪĿ�ĺϳ�ҩ������壬����һ�ֻ�ѧ�ϳ�·�����£�
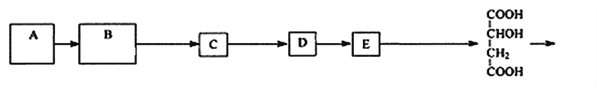
��֪����˹�Լ���ѡ����������������̼�Ĵ��������е�̼̼˫������������Ӱ�죺RCH=CHCH2OH![]() RCH=CHCOOH
RCH=CHCOOH
�ش��������⣺
��1��A�Ľṹ��ʽ��_______________�� D����E�ķ�Ӧ������______________��
��2��D�й����ŵ�������______________________����Ũ����ͼ��������£�1molƻ�����������_______mol̼�����Ʒ�Ӧ��
��3��д��B �� C�Ļ�ѧ����ʽ��________________________________________��
��4��������F��B�������ļӳɲ��F��ͬ���칹�干��_________�֣����������칹��������F����
��5�����������ϳ�·�ߣ��������ϩ[CH2=C(CH3)CH=CH2]Ϊԭ�ϣ����Լ���ѡ������Ʊ�![]() �ĺϳ�·�ߣ�______________________��
�ĺϳ�·�ߣ�______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��ʵ���ǣ�
A.������ʧ��B.���ϼ۵�����
C.��������������D.���ӵĵ�ʧ��ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪ���ֻ������Ԫ�����ʾ��ͼ������˵���������

A. ����Ϊij�־��д����õĻ��������ˮ�����Ϊ������
B. ����Ϊ֬�����������������Ƥ�º�����������Χ
C. ����Ϊ������Ŵ����ʣ�����͵��������Ⱦɫ��
D. ����Ϊ��ԭ��������Ҫ�ֲ����˺Ͷ���ļ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t ��ʱ��0.01 mol/L NaOH��ҺpH��11��0.1 mol/LHA��Һ��![]() ��109��
��109��
��1�����¶��£�ˮ�����ӻ�Kw��________��HA��________(�ǿ��������)�ᡣ
��2�����¶��£���pH֮��Ϊ13��NaOH��Һ��HA��Һ�������Ϻ�������Һ��_____(��ᡱ��������С�)�ԣ�������____________________________________��
��3���������£�������ˮϡ��0.01 mol/L HA��Һʱ�����гʼ�С���Ƶ���________��
A��![]() B��
B��![]() C����Һ��c(H��)��c(OH��)�ij˻�
C����Һ��c(H��)��c(OH��)�ij˻�
D����Һ��c(A��)��c(HA)��ֵ E��ˮ�ĵ���̶�
��4�������£�ȡpH��2�������HA��Һ��100 mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯����ͼ��ʾ��

��ͼ�б�ʾHA��ҺpH�仯���ߵ���________(�A����B��)��
���������м���Zn������Ϊm1��HA��Һ�м���Zn������Ϊm2����m1________m2(�����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ij�ܱ������н������·�Ӧ��
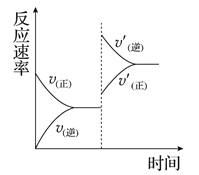
mA(g)��nB(g)![]() pC(g)��qD(g)��������ѹǿ�������¶ȣ����´ﵽƽ�⣬
pC(g)��qD(g)��������ѹǿ�������¶ȣ����´ﵽƽ�⣬
��Ӧ������ʱ��ı仯������ͼ��ʾ����Ը÷�Ӧ��������ȷ����( )
A. ����Ӧ�����ȷ�Ӧ B. �淴Ӧ�Ƿ��ȷ�Ӧ
C. m��n<p��q D. m��n>p��q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ж����й��̵ķ������
A��ˮ�����Է����ɸߴ����ʹ���
B���������еĻ��ɢ��ʱ��Ϊ��������
C�����ȷ�Ӧ�����У����ȷ�Ӧ�����Է�����
D�����ϴ���Ժ��˿��Ƶĺ����ɵĻ������еļ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com