
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下(A~I)均为有机物):

已知:a. 
b.  RCHO
RCHO
回答下列问题:
(1)反应①的化学方程式为_______;F的官能团名称为______。
(2)反应②的类型是_______。D→E所需试剂、条件分别是_______、______。
(3)G的结构简式为____________。
(4)芳香族化合物W的化学式为C8H8O2, 且满足下列条件的W的结构共有_______种(不考虑立体异构)。
i.遇FeCl3溶液显紫色; ii.能发生银镜反应。
其中核磁共振氢谱显示有5种不司化学环境的氢,峰面积比为2:2:2:1:1的是____________(写出结构简式)。
(5)设计以甲苯和乙醛为原料制备 的合成路线。无机试剂任选,合成路线的表示方式为:
的合成路线。无机试剂任选,合成路线的表示方式为:![]() _____________.
_____________.
【答案】![]() +Cl2
+Cl2![]()
![]() +HCl 醛基 取代反应(或酯化反应) NaOH溶液 加热
+HCl 醛基 取代反应(或酯化反应) NaOH溶液 加热 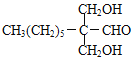 13
13 ![]()
【解析】
甲烷和氯气在光照条件下发生取代反应生成D(CH2Cl2),D在氢氧化钠的水溶液、加热条件下发生取代反应,但同一个碳原子上含有两个羟基不稳定会失水生成醛,则E为HCHO,F是CH3(CH2)6CHO和甲醛反应生成G,根据题给信息知G为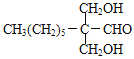 ,G和氢气发生加成反应生成H为
,G和氢气发生加成反应生成H为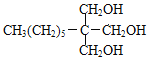 ;甲苯在光照条件下与氯气发生取代反应生成
;甲苯在光照条件下与氯气发生取代反应生成![]() ,水解得到A为
,水解得到A为![]() ,A氧化生成B为
,A氧化生成B为![]() ,B进一步氧化生成C为
,B进一步氧化生成C为![]() ,C与H发生酯化反应生成I为
,C与H发生酯化反应生成I为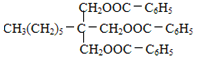 ;
;
(5)苯与氯气在光照条件下生成![]() ,然后发生水解反应生成
,然后发生水解反应生成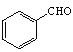 ,最后与乙醛在碱性条件下反应生成目标物。
,最后与乙醛在碱性条件下反应生成目标物。
根据上述分析可知:A为![]() ,B为
,B为![]() ,C为
,C为![]() ,D为CH2Cl2,E为HCHO,F为CH3(CH2)6CHO,G为
,D为CH2Cl2,E为HCHO,F为CH3(CH2)6CHO,G为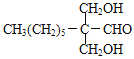 ,H为
,H为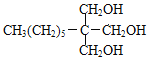 ,I为
,I为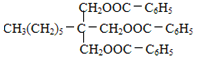 。
。
(1)反应①为甲苯和氯气的取代反应,方程式为:![]() +Cl2
+Cl2![]()
![]() +HCl; F为CH3(CH2)6CHO ,官能团名称为醛基;
+HCl; F为CH3(CH2)6CHO ,官能团名称为醛基;
(2)反应②是C(![]() )与H(
)与H(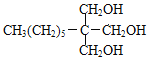 )发生酯化反应或取代反应产生I(
)发生酯化反应或取代反应产生I(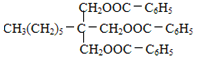 ),反应类型为酯化反应或取代反应;
),反应类型为酯化反应或取代反应;
D为CH2Cl2,E为HCHO,D与NaOH水溶液混合加热发生取代反应产生E,所以D→E所需试剂、条件分别是NaOH溶液、加热;
(3)G的结构简式为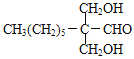 ;
;
(4)化合物W化学式为C8H8O2,W比C多一个-CH2原子团,且满足下列条件,
①遇 FeCl3 溶液显紫色,说明含有酚羟基、苯环;
②能发生银镜反应,说明含有醛基,根据不饱和度知,除了苯环外不含双键或环状结构;
如果存在-OH、-CH2CHO,有邻、间、对3种不同结构;
如果取代基为-OH、-CH3、-CHO,有10种不同结构;
所以符合条件的同分异构体有13种,其中核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为 2:2:2:1:1 的结构简式为![]() ;
;
(5)苯与氯气在光照条件下生成![]() ,
,![]() 发生水解反应生成
发生水解反应生成 ,
, 与CH3CHO发生醛的加成反应产生
与CH3CHO发生醛的加成反应产生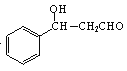 ,故合成路线流程图为:
,故合成路线流程图为: 。
。


科目:高中化学 来源: 题型:
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。
已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;常温下H2C2O4为晶体,易溶于水,溶解度随温度升高而增大。

请回答:
(1)步骤②,发生反应的离子方程式____________________________;该步骤H2C2O4稍过量主要是为了_________________。
(2)下列操作或描述正确的是_______________。
A.步骤①,酸化主要是为了抑制Fe2+水解
B.步骤③,如果采用冷水洗涤可提高除杂效果
C.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
n(Fe2+)/mol | n(C2O42-)·mol-1 | 试样中FeC2O4·2H2O的质量分数 |
9.80×10-4 | 9.80×10-4 | 0.98 |
由表中数据推测试样中最主要的杂质是_________________。
(4)实现步骤④必须用到的两种仪器是_________(供选仪器如下)
a.坩埚;b.烧杯;c.蒸馏烧瓶;d.锥形瓶;e.表面皿:f.高温炉
该步骤的化学方程式是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AG=lg![]() ,电离度α=
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
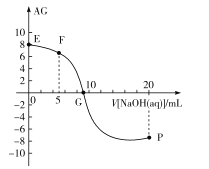
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示物质A~F之间的转化关系,其中A为淡黄色固体物质,B、C为无色溶液,D为气体,E、F为白色沉淀。请填写下列各空:
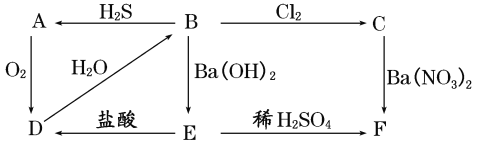
(1)写出各物质的化学式:
A为______,B为_____,C为_____,D为_____,E为_____,F为______。
(2)写出下列反应的化学方程式:
B→A:________________________。
B→C:___________________________。
(3)写出C→F的离子方程式:___________________。
(4)在A~F六种物质中,既有氧化性又有还原性的是(填字母代号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧后的主要产物。
(1)将体积比为2:1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃。将残留固体溶于水,所得溶液中2c(CO32-)+c(HCO3-)____________c(Na+)(填“>”“<”或“=”) 。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol;键能E(o=o)=499.0 kJ/mol
①CO(g)+O2(g)![]() CO2(g)+O(g) 的△H=____________kJ/mol
CO2(g)+O(g) 的△H=____________kJ/mol
②已知2500K时,①中反应的平衡常数为0.40。某时刻该反应体系中各物质浓度满足: c(CO)·c(O2)=c(CO2)·c(O),则此时反应____________(填向左”或“向右”)进行。
(3)已知:反应CO2(g)![]() CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)
CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)![]() 2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2,
2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2, 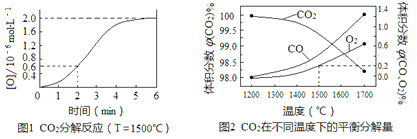
①分析图1,求2min内v(CO2)=_______。
②分析图2,1500℃时反应达平衡,此时容器体积为1 L,则反应的平衡常数K=______(计算结果保留1位小数)。
(4)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
选项 | T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |
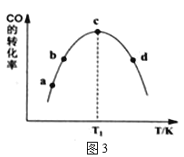
①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。
A. 使用催化剂CuO-ZnO-ZrO2 B. 适当降低反应温度
C. 增大CO和H2的初始投料比 D. 恒容下,再充入a mol CO和3a mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | Ka=1.75×10-5 |
柠檬酸(H3C6H5O7) | Ka1=7.4×10-4 Ka2=1.73×10-5 Ka3=4.0×10-7 |
NH3·H2O | Kb=1.75×10-5 |
请回答下列问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是__________(填字母)。
A.![]()
B.c(H+)
C.c(OH-)·c(H+)
D.![]()
E.![]()
(2)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显_____(填“酸”“碱”或“中”)性,通过计算说明其原因____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25°C时,若向a mol·L-1的HA溶液中,滴加等体积的b mol·L-1的NaOH溶液,使溶液呈中性,用含a的代数式表示HA的电离平衡常数Ka=____________。
(2)25°C时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应完后溶液中c(NH4+)=c(Cl-),则溶液显_____性(填“酸”、“碱”或“中”),用含a的代数式表示NH3·H2O的电离平衡常数Kb=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列关于N及其化合物的问题:
(1)配制Fe(NO3)2溶液时可否加入少量HNO3抑制Fe2+水解?_______,原因是__________________________________________。
(2)汽车尾气中含有大量NO2,会导致环境污染,在汽车尾气管装上电化学转化装置在碱性水溶液环境中形成原电池,可部分解除NO2的污染,则该装置的正极反应方程式为_________________________________;该装置的负极原料为NH3,当电路中转移8mole-时,负极消耗NH3的质量理论值约为________,(保留小数点后一位小数)实际上消耗NH3的量远大于该理论值的原因可能为_________________________________________。
(3)NaOH溶液也可解除NO2的污染,该反应的化学方程式为_____________________________。
(4)第(3)问反应可产生致癌物质NaNO2,该物质中N元素的化合价为_____价,酸性环境中的NaNO2可用H2O2氧化处理,处理过程的离子方程式为___________________,若改用O2来氧化,则68g的H2O2相当于O2的质量为____;(保留小数点后一位小数)使用H2O2作为氧化剂的优点是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pc是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pc(H2A)、pc(HA-)、pc(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是( )
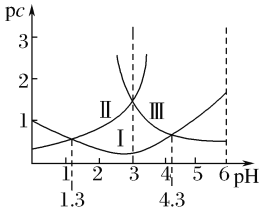
A.pH=4时,c(HA-)<c(A2-)
B.c(H2A)+c(HA-)+c(A2-)是定值
C.常温下,该酸的电离常数Ka1=10-1.3
D.常温下,NaHA的水溶液呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com