
【题目】若定义pc是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pc(H2A)、pc(HA-)、pc(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是( )
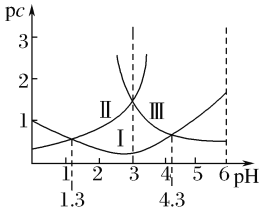
A.pH=4时,c(HA-)<c(A2-)
B.c(H2A)+c(HA-)+c(A2-)是定值
C.常温下,该酸的电离常数Ka1=10-1.3
D.常温下,NaHA的水溶液呈碱性
【答案】C
【解析】
随pH增大,c(H2A)减小、c(HA-)先增后减、c(A2-)增大;根据图示,曲线Ⅰ表示c(HA-)、曲线Ⅱ表示c(H2A)、曲线Ⅲ表示c(A2-);
A、根据图示,pH=4时,c(HA-)>c(A2-),故A错误;
B、调节溶液pH的方法不确定,所以c(H2A)+c(HA-)+c(A2-)不一定是定值,故B错误;
C、根据图示c(H2A)=c(HA-)时,pH=1.3,所以Ka1=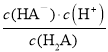 =c(H+)=10-1.3,故C正确;
=c(H+)=10-1.3,故C正确;
D、根据图示c(A2-)=c(HA-)时,pH=4.3,Ka2=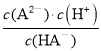 =c(H+)=10-4.3,HA-的水解常数Kh=
=c(H+)=10-4.3,HA-的水解常数Kh=![]() =10-12.7,电离大于水解,所以NaHA的水溶液呈酸性,故D错误。
=10-12.7,电离大于水解,所以NaHA的水溶液呈酸性,故D错误。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下(A~I)均为有机物):

已知:a. 
b.  RCHO
RCHO
回答下列问题:
(1)反应①的化学方程式为_______;F的官能团名称为______。
(2)反应②的类型是_______。D→E所需试剂、条件分别是_______、______。
(3)G的结构简式为____________。
(4)芳香族化合物W的化学式为C8H8O2, 且满足下列条件的W的结构共有_______种(不考虑立体异构)。
i.遇FeCl3溶液显紫色; ii.能发生银镜反应。
其中核磁共振氢谱显示有5种不司化学环境的氢,峰面积比为2:2:2:1:1的是____________(写出结构简式)。
(5)设计以甲苯和乙醛为原料制备 的合成路线。无机试剂任选,合成路线的表示方式为:
的合成路线。无机试剂任选,合成路线的表示方式为:![]() _____________.
_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用平衡移动原理解释的是( )
A.新制氯水中加入CaCO3固体可增大HClO分子的浓度
B.钢铁在潮湿的空气中比在干燥空气中更容易生锈
C.通入过量的空气与SO2反应可以提高SO2的利用率
D.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第20届中国国际工业博览会上,华东师范大学带来的一种“锌十碘”新型安全动力电池亮相工博会高校展区。该新型安全动力电池无污染、高安全、长寿命且具有合适的充电时间,可以应用于日常生活、交通出行等各个领域。已知该电池的工作原理如图所示。下列有关说法正确的是( )
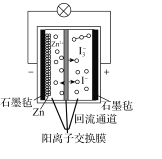
A.正极反应式为I3--2e-=3I-
B.6.5gZn溶解时,电解质溶液中有0.2mol电子移动
C.转移1mol电子时,有1molZn2+从左池移向右池
D.“回流通道”可以减缓电池两室的压差,避免电池受损
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。

已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO3-;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是_____,检査装置E气密性的方法是_____。
(2)上述实验装置中,依次连接的合理顺序为h-_____。
(3)装置D中酸性KMnO4溶液的作用是_____(用离子方程式表示)。
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为_____。
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入50.00mL0.001mol/L酸性高锰酸钾溶液,充分反应后用0.001mol·L-1草酸钠溶液滴定剩余的高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为_____mg·L-1。若所取样品在空气中放置时间过长,则测定结果_____(填“偏高”“偏低”或“无影响”)。
有关反应如下:
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是解决化学分析问题的常用方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.如图为某浓度的NaOH溶液滴定10.00mL一定浓度的盐酸的示意图。根据图像

(1)HCl溶液的浓度是__________;NaOH溶液的浓度是_______;
(2)x=________。
(3)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。


ΙΙ.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
(4)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
①滴定时,盛放高锰酸钾溶液的仪器名称为_________确定反应达到终点的现象_____________。
②草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO42-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据所给数据计算血液样品中Ca2+离子的浓度为__________mg/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用以下装置电解饱和食盐水,同时测定电解时产生的氢气的体积和检验氯气的氧化性。

(1)所选仪器连接时,各接口的顺序是(填各接口的代号字母):A 接_____,_____接_____,B接_____,_______接_____________。
(2)实验时用石墨和铁为电极,则铁电极接电源的_____极,所发生的电极反应式为_____。
(3)实验测得产生的氢气体积(已折算成标准状况)为 5.60 mL,电解后溶液的体积恰好为 50.0 mL,则溶液中 OH-的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以低品位红土镍矿(主要成分可表示为![]() 、
、![]() 、
、![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]() 、
、![]() )为原料制备纳米级
)为原料制备纳米级![]() 的工艺流程如下:
的工艺流程如下:

已知氢氧化物的参数如下表:
氢氧化物 | 溶度积 | 开始沉淀 | 完全沉淀 |
|
| 4.1 | 5.5 |
|
| 2.2 | 3.5 |
|
| 6.7 | 9.5 |
|
| 9.4 | 12.4 |
回答下列问题:
(1)“滤渣Ⅰ”的主要成分是______(填化学式)。
(2)常温下,调![]() 的目的是______。当
的目的是______。当![]() 时,溶液中
时,溶液中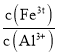 =______
=______
(3)写出“除铜镍”过程发生反应的离子方程式为![]() 、______________。“除钙”过程反应温度不宜超过
、______________。“除钙”过程反应温度不宜超过![]() 的原因_________________________。
的原因_________________________。
(4)“滤液”中溶质的主要成分为________________,获取该物质晶体的具体实验操作为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用合成EPR橡胶![]() 的两种单体A和B合成PC塑料
的两种单体A和B合成PC塑料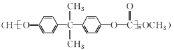 其合成路线如下:
其合成路线如下:
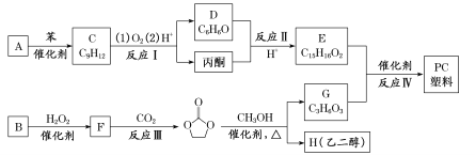
已知:①RCOOR1+R2OH![]() RCOOR2+R1OH
RCOOR2+R1OH
②(CH3)2C=CHCH3+H2O2![]()
 +H2O
+H2O
③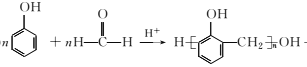 +(n-1)H2O
+(n-1)H2O
回答下列问题:
(I)F的结构简式为__________,反应Ⅲ的反应类型为___________。
(2)C的名称为__________。
(3)写出反应Ⅳ的化学方程式:____________________。
(4)从下列选项中选择______试剂,可以一次性鉴别开D、G、H三种物质。(填字母)
A.氯化铁溶液 B.浓溴水 C.酸性KMnO4溶液
(5)满足下列条件的有机物E的同分异构体有__________种。
①与E属于同类别物质;②核磁共振氢谱有6组峰,峰面积比为1:1:1:1:1:3。
(6)以丙烯和丙酮为原料合成![]() ,无机试剂任选,写出合成路线__________________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,无机试剂任选,写出合成路线__________________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com