
【题目】第20届中国国际工业博览会上,华东师范大学带来的一种“锌十碘”新型安全动力电池亮相工博会高校展区。该新型安全动力电池无污染、高安全、长寿命且具有合适的充电时间,可以应用于日常生活、交通出行等各个领域。已知该电池的工作原理如图所示。下列有关说法正确的是( )
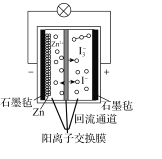
A.正极反应式为I3--2e-=3I-
B.6.5gZn溶解时,电解质溶液中有0.2mol电子移动
C.转移1mol电子时,有1molZn2+从左池移向右池
D.“回流通道”可以减缓电池两室的压差,避免电池受损
科目:高中化学 来源: 题型:
【题目】下图表示物质A~F之间的转化关系,其中A为淡黄色固体物质,B、C为无色溶液,D为气体,E、F为白色沉淀。请填写下列各空:
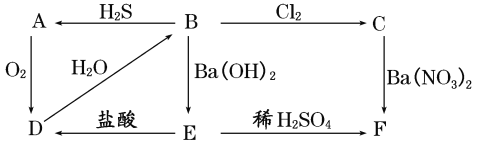
(1)写出各物质的化学式:
A为______,B为_____,C为_____,D为_____,E为_____,F为______。
(2)写出下列反应的化学方程式:
B→A:________________________。
B→C:___________________________。
(3)写出C→F的离子方程式:___________________。
(4)在A~F六种物质中,既有氧化性又有还原性的是(填字母代号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列关于N及其化合物的问题:
(1)配制Fe(NO3)2溶液时可否加入少量HNO3抑制Fe2+水解?_______,原因是__________________________________________。
(2)汽车尾气中含有大量NO2,会导致环境污染,在汽车尾气管装上电化学转化装置在碱性水溶液环境中形成原电池,可部分解除NO2的污染,则该装置的正极反应方程式为_________________________________;该装置的负极原料为NH3,当电路中转移8mole-时,负极消耗NH3的质量理论值约为________,(保留小数点后一位小数)实际上消耗NH3的量远大于该理论值的原因可能为_________________________________________。
(3)NaOH溶液也可解除NO2的污染,该反应的化学方程式为_____________________________。
(4)第(3)问反应可产生致癌物质NaNO2,该物质中N元素的化合价为_____价,酸性环境中的NaNO2可用H2O2氧化处理,处理过程的离子方程式为___________________,若改用O2来氧化,则68g的H2O2相当于O2的质量为____;(保留小数点后一位小数)使用H2O2作为氧化剂的优点是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物对化工生产有重要意义。
(1)已知:
①N2(g)+O2(g)=2NO(g) △H1
②2NH3(g)![]() N2(g)+3H2(g) △H2
N2(g)+3H2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
则热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=_____(用△H1,△H2,△H3表示)。
(2)在2L密闭绝热容器中,投入4molN2和6molH2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如下表:
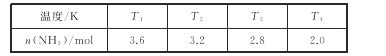
①下列能说明该反应已达到平衡状态的是_____。
A.3v正(H2)=2v逆(NH3)
B.容器内气体压强不变
C.混合气体的密度不变
D.混合气的温度保持不变
②温度T1_____(填“>”<”或“=”)T3。
③在T4温度下,达到平衡时N2的转化率为_____。
(3)N2O4为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)=2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,v逆=_____kPa·s-1。
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图。阴极的电极反应式为_____,电解槽中的隔膜为_____(填“阳”或“阴”)离子交换膜。每处理1molNO,电路中通过电子的物质的量为_____。
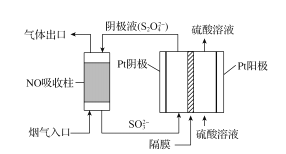
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源,石墨为电极电解CuSO4溶液(足量),装置如下图。若一段时间后Y电极上有6.4 g红色物质析出,停止电解。下列说法正确的是( )
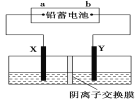
A.a为铅蓄电池的负极
B.电解过程中SO42-向右侧移动
C.电解结束时,左侧溶液质量增重8 g
D.铅蓄电池工作时正极电极反应式为:PbSO4+2e-===Pb+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1CH3COOH
溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pc是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pc(H2A)、pc(HA-)、pc(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是( )
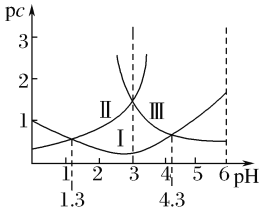
A.pH=4时,c(HA-)<c(A2-)
B.c(H2A)+c(HA-)+c(A2-)是定值
C.常温下,该酸的电离常数Ka1=10-1.3
D.常温下,NaHA的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是目前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如图:
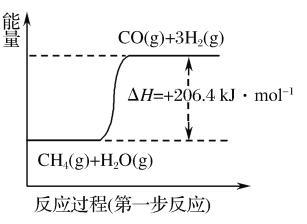

结合图象,写出CH4通过蒸汽转化为CO2和H2的热化学方程式:___。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)。
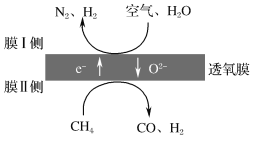
①起还原作用的物质是___。
②膜Ⅰ侧所得气体中![]() =2,CH4、H2O、O2反应的化学方程式是___。
=2,CH4、H2O、O2反应的化学方程式是___。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是___。
2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是___。
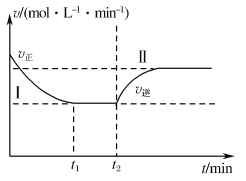
A.Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:φ(Ⅰ)<φ(Ⅱ)
C.Ⅰ、Ⅱ两过程达到平衡的标志是混合气体的密度不再发生变化
D.t2min时改变的条件可以是向密闭容器中加N2和H2的混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器中充入9.0molN2和23.0molH2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图。
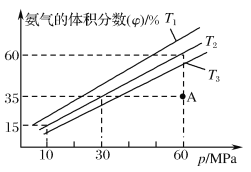
①T1、T2、T3由大到小的排序为___。
②在T2、60MPa条件下,A点v正___(填“>”“<”或“=”)v逆,理由是___。
③计算T2、60MPa平衡体系的平衡常数Kp=___MPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶解度也可用物质的量浓度表示,25℃时,Ag2CrO4在不同浓度CrO42-溶液中的溶解度如图所示。又知Ksp(AgCl)=1.8×10-10。下列说法正确的是
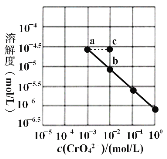
A.图中a、b两点c(Ag+)相同
B.该温度下,Ag2CrO4溶度积的数量级为10-12
C.加热蒸发饱和Ag2CrO4溶液再恢复到25℃,可使溶液由a点变到b点
D.将0.01 mol/L AgNO3溶液滴入20mL0.01 mol/L KCl和0.01 mol/L K2CrO4的混合溶液中,CrO42-先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com