
【题目】氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是目前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如图:
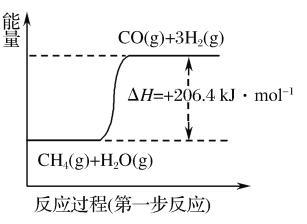

结合图象,写出CH4通过蒸汽转化为CO2和H2的热化学方程式:___。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)。
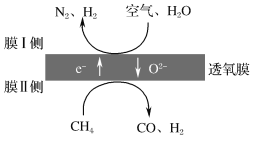
①起还原作用的物质是___。
②膜Ⅰ侧所得气体中![]() =2,CH4、H2O、O2反应的化学方程式是___。
=2,CH4、H2O、O2反应的化学方程式是___。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是___。
2NH3(g) ΔH<0。t1 min时达到平衡,在t2 min时改变某一条件,其反应过程如图所示,下列说法正确的是___。
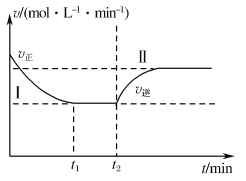
A.Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:φ(Ⅰ)<φ(Ⅱ)
C.Ⅰ、Ⅱ两过程达到平衡的标志是混合气体的密度不再发生变化
D.t2min时改变的条件可以是向密闭容器中加N2和H2的混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器中充入9.0molN2和23.0molH2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图。
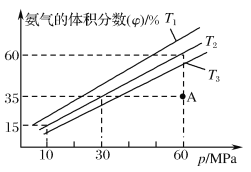
①T1、T2、T3由大到小的排序为___。
②在T2、60MPa条件下,A点v正___(填“>”“<”或“=”)v逆,理由是___。
③计算T2、60MPa平衡体系的平衡常数Kp=___MPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留2位有效数字)。
【答案】CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165.4 kJ·mol-1 CH4 10CH4+8H2O+O2=10CO+28H2 D T3>T2>T1 > T2、60MPa时A点未达到平衡时的体积分数,反应正向进行 0.043或0.0427(MPa)-2
【解析】
(1).结合图象可知,第一步反应的热化学方程式为①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1,第二步反应的热化学方程式为②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.0 kJ·mol-1,根据盖斯定律,由①+②得:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165.4 kJ·mol-1,故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165.4 kJ·mol-1;
(2).①结合工作原理图知,膜Ⅰ侧反应物为空气中的O2和H2O,得电子生成O2-和H2;膜Ⅱ侧反应物为CH4和O2-,失去电子生成CO和H2,起还原作用的是CH4,故答案为:CH4;
②设膜Ⅰ侧参加反应的空气中的n(N2)=4 mol、n(O2)=1 mol,则膜Ⅰ侧所得气体中n(N2)=4 mol、n(H2)=8 mol,膜Ⅰ侧的还原反应为O2+4e-=2O2-和H2O+2e-===H2↑+O2-,则n(O2)反应=1 mol,n(H2O)反应=8 mol,膜Ⅱ侧的氧化反应为CH4+O2--2e-=2H2+CO,根据得失电子守恒,膜Ⅱ侧n(CH4)反应=10 mol,故CH4、H2O、O2反应的化学方程式为10CH4+8H2O+O2=10CO+28H2;故答案为:10CH4+8H2O+O2=10CO+28H2;
(3).温度不变,平衡常数K不变,A项错误;若t2 min时改变的条件是大量通入N2或H2,则平衡时NH3的体积分数:φ(Ⅱ)<φ(Ⅰ),B项错误;容器恒容,且过程Ⅰ和Ⅱ中混合气体的质量不变,混合气体的密度为固定值,C项错误;t2 min时改变条件,v逆瞬时不变后逐渐增大至不变,则平衡正向移动,所以改变的条件是向容器中加入反应物(可以是N2或H2或N2和H2的混合气),D项正确,故选D;
(4).①合成氨反应的正反应为放热反应,温度越高平衡时NH3的体积分数越小,所以T3>T2>T1;故答案为:T3>T2>T1;
②在T2、60 MPa条件下,A点时NH3的体积分数小于平衡时NH3的体积分数,此时反应正向进行,所以v正>v逆,故答案为:>;T2、60MPa时A点未达到平衡时的体积分数,反应正向进行;
③结合图象知T2、60 MPa平衡时NH3的体积分数为60%,则平衡时φ(N2)=15%,φ(H2)=25%,Kp=(60MPa×60%)2/[(60 MPa×15%)×(60 MPa×25%)3]≈0.043(MPa)-2,故答案为:0.043或0.0427(MPa)-2。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】曲美替尼是一种抑制黑色素瘤的新型抗癌药物,下面是合成曲美替尼中间体G的反应路线:
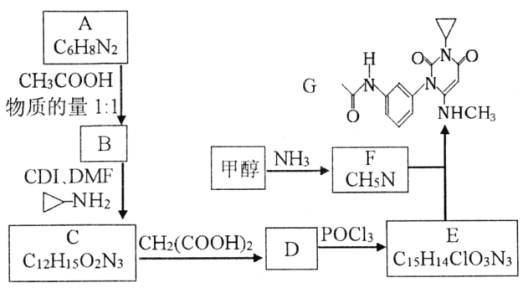
已知:①D分子中有2个6元环;
请回答:
(1)化合物A的结构简式___________。A生成B的反应类型___________。
(2)下列说法不正确的是___________。
A.B既能表现碱性又能表现酸性
B.1moC在碱溶液中完全水解最多可以消耗4 molOH-
C.D与POCl3的反应还会生成E的一种同分异构体
D.G的分子式为C16H18O3N4
(3)写出C→D的化学方程式____________________________________________。
(4)X是比A多2个碳原子的A的同系物,写出符合下列条件的X可能的结构简式:_______________________________________________________。
①1H-NMR谱显示分子中有3种氢原子,②IR谱显示分子中有苯环与-NH2相连结构
(5)流程中使用的DMF即N,N-二甲基甲酰胺结构简式为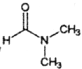 ,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________
,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第20届中国国际工业博览会上,华东师范大学带来的一种“锌十碘”新型安全动力电池亮相工博会高校展区。该新型安全动力电池无污染、高安全、长寿命且具有合适的充电时间,可以应用于日常生活、交通出行等各个领域。已知该电池的工作原理如图所示。下列有关说法正确的是( )
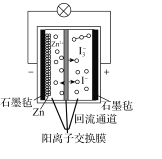
A.正极反应式为I3--2e-=3I-
B.6.5gZn溶解时,电解质溶液中有0.2mol电子移动
C.转移1mol电子时,有1molZn2+从左池移向右池
D.“回流通道”可以减缓电池两室的压差,避免电池受损
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是解决化学分析问题的常用方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.如图为某浓度的NaOH溶液滴定10.00mL一定浓度的盐酸的示意图。根据图像

(1)HCl溶液的浓度是__________;NaOH溶液的浓度是_______;
(2)x=________。
(3)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。


ΙΙ.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
(4)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
①滴定时,盛放高锰酸钾溶液的仪器名称为_________确定反应达到终点的现象_____________。
②草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO42-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据所给数据计算血液样品中Ca2+离子的浓度为__________mg/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用以下装置电解饱和食盐水,同时测定电解时产生的氢气的体积和检验氯气的氧化性。

(1)所选仪器连接时,各接口的顺序是(填各接口的代号字母):A 接_____,_____接_____,B接_____,_______接_____________。
(2)实验时用石墨和铁为电极,则铁电极接电源的_____极,所发生的电极反应式为_____。
(3)实验测得产生的氢气体积(已折算成标准状况)为 5.60 mL,电解后溶液的体积恰好为 50.0 mL,则溶液中 OH-的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵俗称卤砂,主要用于干电池、化肥等。某化学研究小组设计如图实验制备卤砂并进行元素测定。
Ⅰ.实验室制备卤砂所需的装置如图所示,装置可重复选用。

(1)装置接口连接顺序是___→a;b←___。
(2)C装置的作用是___,D装置盛装的物质是___。
(3)写出用上述装置制备氨气的一组试剂:___。
Ⅱ.测定卤砂中Cl元素和N元素的质量之比。
该研究小组准确称取ag卤砂,与足量氧化铜混合加热,充分反应后把气体产物按如图装置进行实验。收集装置收集到的气体为空气中含量最多的气体,其体积换算成标准状况下的体积为VL,碱石灰增重bg。

(4)E装置内的试剂为___,卤砂与氧化铜混合加热反应的化学方程式为___。
(5)卤砂中Cl元素和N元素的质量之比为___(用含b、V的式子表示)。
(6)为了测定卤砂中氯元素的质量,他们设计的实验方案是将ag卤砂完全溶解于水,加入过量AgNO3溶液,然后测定生成沉淀的质量。请你评价该方案是否合理,并说明理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以低品位红土镍矿(主要成分可表示为![]() 、
、![]() 、
、![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]() 、
、![]() )为原料制备纳米级
)为原料制备纳米级![]() 的工艺流程如下:
的工艺流程如下:

已知氢氧化物的参数如下表:
氢氧化物 | 溶度积 | 开始沉淀 | 完全沉淀 |
|
| 4.1 | 5.5 |
|
| 2.2 | 3.5 |
|
| 6.7 | 9.5 |
|
| 9.4 | 12.4 |
回答下列问题:
(1)“滤渣Ⅰ”的主要成分是______(填化学式)。
(2)常温下,调![]() 的目的是______。当
的目的是______。当![]() 时,溶液中
时,溶液中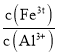 =______
=______
(3)写出“除铜镍”过程发生反应的离子方程式为![]() 、______________。“除钙”过程反应温度不宜超过
、______________。“除钙”过程反应温度不宜超过![]() 的原因_________________________。
的原因_________________________。
(4)“滤液”中溶质的主要成分为________________,获取该物质晶体的具体实验操作为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下浓度均为![]() 的几种溶液①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
的几种溶液①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③______⑥(填>、=、<),溶液中的离子浓度由大到小的顺序为________________。
(2)将等体积的①、⑤混合,则溶液的pH______7(填>、=、<),用离子方程式说明其原因____________________。
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为_____________,最终产生![]() 总量的关系为__________。
总量的关系为__________。
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的![]() 溶液,充分混合后,混合液的pH大小关系为①______③(填>、=、<)。
溶液,充分混合后,混合液的pH大小关系为①______③(填>、=、<)。
(5)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH⑤_______⑥(填>、=、<)。
(6)将等体积的②、⑤混合,则溶液中浓度最大的离子是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 水电离的c(H+)=1×10-13mol/L 的溶液中:K+、Na+、SiO32-、SO42-
B. 1.0mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl-
C. 在c(OH-):c(H+)=1×1012的溶液: NH4+、Ca2+、Cl-、K+
D. 滴入酚酞试剂不变色的溶液:Na+、CO32-、NO3-、SO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com