
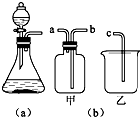
 (1)若用上述装置制取O2,除了可选择二氧化锰和
(1)若用上述装置制取O2,除了可选择二氧化锰和

 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
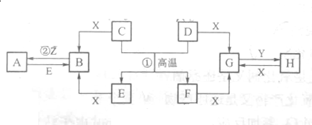 已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).
已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
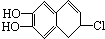 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )| A、1mol、2mol |
| B、2mol、3mol |
| C、3mol、2mol |
| D、3mol、3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>③>② |
| B、③>②>① |
| C、②>③>① |
| D、①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
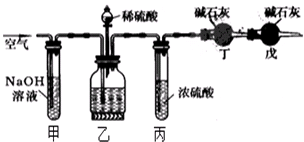 工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:
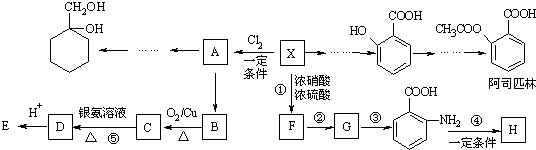
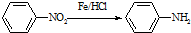 (苯胺,易被氧化)
(苯胺,易被氧化)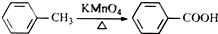
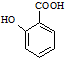 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有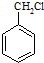 和其他无机物合成
和其他无机物合成 最合理的方案(不超过4步).例:
最合理的方案(不超过4步).例:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物中Cu的物质的量为0.2 mol |
| B、产生的NO在标准状况下的体积为4.48L |
| C、硝酸的物质的量浓度为2.6mol/L |
| D、Cu?Cu2O与硝酸反应后剩余HNO3为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.38g |
| B、34.58g |
| C、4.16g |
| D、34.41g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com