
| A、①中所得溶液中c(Cl-)-c(M+)=9.9×10-7mol/L |
| B、①c(H+)-c(MOH)=1×10-8mol/L |
| C、由②中信息知MOH的电离程度<M+的水解程度 |
| D、②中所得溶液中各离子浓度大小关系为:c(M+)>c(Cl-)>c(H+)>c(OH-) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| a |
| b |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
| 序号 | 已知情境 | 化学式 | 对应的离子反应方程式和现象 |
| (1) | 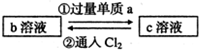 已知b溶液中滴入KSCN溶液后,溶液呈红色. |
a |
反应①的离子方程式 反应②的离子方程式 |
| (2) |  已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5. 已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5. |
c |
反应③的现象为 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.
铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氯化钴溶液中加入一定量的浓盐酸,溶液颜色的变化是由粉红色变为蓝色 |
| B、已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量的CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4的溶解度比在水中的大 |
| C、在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸中,待产生氢气的速率速率突然减小,可以判断锌镀层已反应完全 |
| D、标定NaOH溶液的基准物质可用草酸、苯甲酸、邻苯二甲酸氢钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1L 1mol/L的AlCl3溶液中Al3+数是0.1NA |
| B、标准状况下,2.24L甲烷分子的电子数是NA |
| C、25℃时,pH=13的1.0L的Ba(OH)2溶液中含有的OH-数是0.2 NA |
| D、0.1L 1mol/L的醋酸溶液中的分子数是0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸盐和盐酸反应生成CO2和水 |
| B、碳酸盐和强酸反应生成CO2和水 |
| C、可溶性碳酸盐和强酸反应生成CO2和水 |
| D、可溶性酸式碳酸盐和强酸反应生成CO2和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com