
【题目】将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是
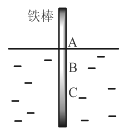
A.铁棒AB段发生反应为O2+ 4e-+ 2H2O = 4OH-
B.腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段
C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响
D.产生这种现象的本质原因是铁棒所处的化学环境不同
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)已知在氨水中存在下列平衡:NH3·H2O![]() NH4++OH-。
NH4++OH-。
①向氨水中加入NH4Cl固体时,平衡__移动(填“向右”或“向左”),c(OH-)__(填“增大”或“减小”)。
②向氨水中加水稀释时,平衡___移动(填“向右”或“向左”)。
(2)FeCl3净水的原理是(用离子方程式表示)__,将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是__(写化学式)。
(3)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则此KHC2O4溶液中c(C2O42-)__c(H2C2O4)(填“大于”或“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )

A. b点达到平衡状态
B. b点与a点相比,c(NO2)、c(N2O4)均减小
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时,5v正(O2)=4v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水(H2O2)和水都是极弱电解质,但H2O2溶液显酸性
(1)若把H2O2看成二元弱酸。请写出其在水中的电离方程式:_________。
(2)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案:
实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
Ⅰ | 5% | 0.2g | 20°C | |
Ⅱ | 5% | 0.5g | 20°C | |
Ⅲ | 10% | 0.2g | 20°C |

①利用实验Ⅰ和Ⅲ,探究________对化学反应速率的影响,实验待测数据是_________:若在本组实验中现象不明显,可采取的措施是_________________。
(3)加0.1 mol MnO2,粉末于50mL过氧化氢溶液(H2O2,ρ=1.1 gmL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。

①前4min内氧气的产生速率为________mLmin-1
②A、B、C、D各点反应速率由快到慢的顺序为_____________。
③解释反应速率变化的原因_________________。
④计算H2O2初始状态的浓度______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
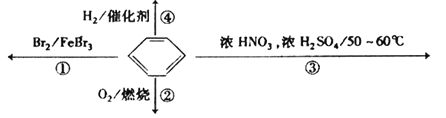
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:
2X(g)+Y(g)![]() 2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
A. 将容器体积变为10L,Z的平衡浓度变为原来的![]()
B. 在该温度下,该反应的平衡常数K=0.011
C. 达到平衡时,容器内气体的压强是原来的90%
D. 若降低温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com