
【题目】(1)已知在氨水中存在下列平衡:NH3·H2O![]() NH4++OH-。
NH4++OH-。
①向氨水中加入NH4Cl固体时,平衡__移动(填“向右”或“向左”),c(OH-)__(填“增大”或“减小”)。
②向氨水中加水稀释时,平衡___移动(填“向右”或“向左”)。
(2)FeCl3净水的原理是(用离子方程式表示)__,将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是__(写化学式)。
(3)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则此KHC2O4溶液中c(C2O42-)__c(H2C2O4)(填“大于”或“小于”或“等于”)。
【答案】向左 减小 向右 Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ Al2O3 大于
Fe(OH)3(胶体)+3H+ Al2O3 大于
【解析】
(1)①向氨水中加入NH4Cl固体时,NH4Cl溶于水发生电离,NH4Cl=NH4++OH-,增大了溶液中的c(NH4+),从而使平衡向左移动,c(OH-)减小。答案为:向左;减小;
②向氨水中加水稀释时,同等程度地减小了反应物和生成物的浓度,但生成物的总浓度减小的更多,从而使平衡向右移动。答案为:向右;
(2)FeCl3净水的原理是Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,在AlCl3溶液中存在下列平衡: AlCl3+3H2O
Fe(OH)3(胶体)+3H+,在AlCl3溶液中存在下列平衡: AlCl3+3H2O![]() Al(OH)3+3HCl,在蒸干、灼烧过程中,HCl挥发、促进水解,得到氢氧化铝固体,Al(OH)3分解:2Al(OH)3
Al(OH)3+3HCl,在蒸干、灼烧过程中,HCl挥发、促进水解,得到氢氧化铝固体,Al(OH)3分解:2Al(OH)3![]() Al2O3+3H2O,最后得到的主要固体产物是Al2O3。答案为:Fe3++3H2O
Al2O3+3H2O,最后得到的主要固体产物是Al2O3。答案为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;Al2O3;
Fe(OH)3(胶体)+3H+;Al2O3;
(3)0.1mol/L的KHC2O4的pH为4.8,溶液显酸性,说明在此KHC2O4溶液中,HC2O4-![]() C2O42-+H+是主要反应,HC2O4-+H2O
C2O42-+H+是主要反应,HC2O4-+H2O![]() H2C2O4+OH-是次要反应,因此c(C2O42-)大于c(H2C2O4)。答案为:大于。
H2C2O4+OH-是次要反应,因此c(C2O42-)大于c(H2C2O4)。答案为:大于。


科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
① I2(g)+ H2(g)![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
② I2(s)+ H2(g)![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.反应①的产物比反应②的产物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到化学平衡状态的可逆反应:A+B ![]() C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )
C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )

A.A、B、C是气体,D不是气体
B.A、B是气体,C、D有一种是气体
C.C、D是气体,A、B有一种是气体
D.C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是
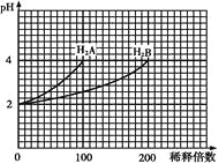
A.H2A为二元强酸
B.pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B)
D.Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
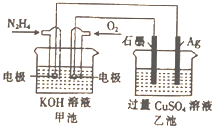
A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列物质的性质,判断其应用错误的是![]()
A.碳酸钠溶液呈碱性,可用于清洗油污
B.水与乙醇以任意比例互溶,可用水洗、分液的方法除去溴乙烷中的乙醇
C.镧镍合金能大量吸收![]() 形成金属氢化物,可作储氢材料
形成金属氢化物,可作储氢材料
D.游泳池中常加入硫酸铜,其主要作用是铜离子水解生成![]() 胶体,能吸咐池中的悬浮物
胶体,能吸咐池中的悬浮物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为主要原料可以制备乙二醇,相关工艺流程如下:

(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式_______
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是_____填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成份为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为____________________。
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g)![]() HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O![]() HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH
①草酸是二元弱酸,可以制备![]() (草酸氢钾),
(草酸氢钾),![]() 溶液呈酸性,用化学平衡原理解释:__________________。
溶液呈酸性,用化学平衡原理解释:__________________。
②在一定的![]() 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
A.![]()
B.![]()
C.![]()
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的_____填“正”或“负”)极,负极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是
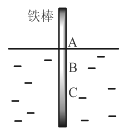
A.铁棒AB段发生反应为O2+ 4e-+ 2H2O = 4OH-
B.腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段
C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响
D.产生这种现象的本质原因是铁棒所处的化学环境不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com