
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是
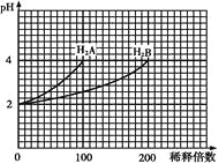
A.H2A为二元强酸
B.pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B)
D.Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+)
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2的热值(单位质量的燃料完全燃烧时所放出的热量,叫做燃料的热值)为142.9kJg-1,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l) △H=-285.8kJmol-1
B.反应A(g)=2B(g),若正反应的活化能为EakJmol-1,逆反应的活化能为EbkJmol-1,则△H=(Ea-Eb)kJmol-1
C.能自发进行的化学反应,一定是△H<0、△S>0
D.增大反应物浓度,可增大单位体积内活化分子百分数,从而增加有效碰撞的次数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向含有等物质的量浓度的![]() 、NaOH混合物中滴加稀盐酸至过量,其中主要含碳物质
、NaOH混合物中滴加稀盐酸至过量,其中主要含碳物质![]() 、
、![]() 、
、![]() 的分布分数
的分布分数![]() 平衡时某物质的浓度占各物质浓度之和的分数
平衡时某物质的浓度占各物质浓度之和的分数![]() 与滴加盐酸体积的关系如图所示
与滴加盐酸体积的关系如图所示![]() 忽略滴加过程
忽略滴加过程![]() 气体的逸出
气体的逸出![]() 。下列说法不正确的是( )
。下列说法不正确的是( )

A.曲线B表示![]()
B.在滴加盐酸过程中溶液中![]() 与含碳各物质浓度的大小关系:
与含碳各物质浓度的大小关系:![]()
C.X、Y为曲线的两交叉点,若能知道X点处的pH就可以计算出![]() 的
的![]() 的值
的值
D.溶液中X、Y两点水电离出的![]() :
:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在室温下可能大量共存的是( )
A.pH=2的溶液:HCO3-、Na+、ClO-、NO3-
B.![]() =106的溶液:Al3+、NH4+、CO32-、S2-
=106的溶液:Al3+、NH4+、CO32-、S2-
C.水电离出的c(H+)=10-4mol/L的溶液:Na+、Fe3+、SO42-、Cl-
D.使石蕊呈红色的溶液:NH4+、NO3-、AlO2-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000mol·L-1 NaOH溶液滴定 20.00mL0.1000mol·L-1某一元酸HA溶液,滴定曲线如图。下列说法正确的是( )
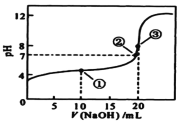
A. HA是强电解质
B. 点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C. 点②所示溶液中:c(Na+) =c(HA) +c(A-)
D. 水的电离程度随着NaOH溶液的滴入,不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在氨水中存在下列平衡:NH3·H2O![]() NH4++OH-。
NH4++OH-。
①向氨水中加入NH4Cl固体时,平衡__移动(填“向右”或“向左”),c(OH-)__(填“增大”或“减小”)。
②向氨水中加水稀释时,平衡___移动(填“向右”或“向左”)。
(2)FeCl3净水的原理是(用离子方程式表示)__,将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是__(写化学式)。
(3)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则此KHC2O4溶液中c(C2O42-)__c(H2C2O4)(填“大于”或“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解质溶液为碱性溶液,阳离子向正极移动
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
4NO(g)+6H2O(g) △H=-905.9kJ·mol-1。下列叙述正确的是
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时,5v正(O2)=4v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com