
【题目】双氧水(H2O2)和水都是极弱电解质,但H2O2溶液显酸性
(1)若把H2O2看成二元弱酸。请写出其在水中的电离方程式:_________。
(2)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案:
实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
Ⅰ | 5% | 0.2g | 20°C | |
Ⅱ | 5% | 0.5g | 20°C | |
Ⅲ | 10% | 0.2g | 20°C |

①利用实验Ⅰ和Ⅲ,探究________对化学反应速率的影响,实验待测数据是_________:若在本组实验中现象不明显,可采取的措施是_________________。
(3)加0.1 mol MnO2,粉末于50mL过氧化氢溶液(H2O2,ρ=1.1 gmL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。

①前4min内氧气的产生速率为________mLmin-1
②A、B、C、D各点反应速率由快到慢的顺序为_____________。
③解释反应速率变化的原因_________________。
④计算H2O2初始状态的浓度______________。
【答案】H2O2 H++HO2-、HO2- H++O22- 浓度 收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积);升高到相同的温度 将三个实验升高到相同的温度; 15mL/min D>C>B>A 刚开始时受温度和浓度两方面的影响,速率较快,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小 0.107 molL1
【解析】
(1)过氧化氢是弱电解质,属于二元弱酸分步电离;
(2)①根据控制单一变量法,比较实验Ⅰ和Ⅲ的数据可知,两个实验中二氧化锰的质量和实验温度都是相同的,只有双氧水溶液的浓度不同,则探究的是浓度对化学反应速率的影响;可以通过测定收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积)来比较反应速率的快慢;若在本组实验中现象不明显,可采取的措施是升高到相同的温度;
(3)①前4min内生成60mL氧气,根据速率单位可知,该速率用单位时间内的体积变化来表示;
②反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
③2H2O2 ![]() 2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大,所以速率逐渐减小;
2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大,所以速率逐渐减小;
④2H2O2 ![]() 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,则可列比例式计算n(H2O2),进而计算其浓度。
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,则可列比例式计算n(H2O2),进而计算其浓度。
(1)过氧化氢是弱电解质,H2O2溶液显酸性,属于二元弱酸,分步电离,电离的方程式为:H2O2 H++HO2-、HO2- H++O22-;
故答案为:H2O2 H++HO2-、HO2- H++O22-;
(2)①比较实验Ⅰ和Ⅲ的数据可知,两个实验中二氧化锰的质量和实验温度都是相同的,只有双氧水溶液的浓度不同,则探究的是浓度对化学反应速率的影响,可以通过测定收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积)来比较反应速率的快慢;若在本组实验中现象不明显,可采取的措施是将三个实验升高到相同的温度;
故答案为:浓度;收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积);将三个实验升高到相同的温度;
(3)①前4min内生成60mL氧气,则氧气的产生速率为![]() ;
;
故答案为:15mL/min;
②反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
故答案为:D>C>B>A;
③2H2O2 ![]() 2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大(减小的较多),所以速率逐渐减小;,
2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大(减小的较多),所以速率逐渐减小;,
故答案为:刚开始时受温度和浓度两方面的影响,速率较快,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
④2H2O2 ![]() 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,则可列比例式:
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,则可列比例式:
2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L![]() ,解得:n(H2O2)=0.00536mol,所以
,解得:n(H2O2)=0.00536mol,所以![]() ;
;
故答案为:0.107 molL1。


科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用。
I.氧化铁是重要工业颜料,用废铁屑制备它的流程如图:
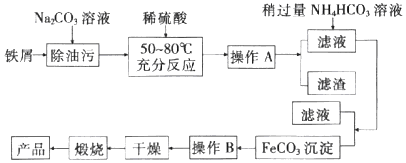
回答下列问题:
![]() 操作A、B的名称分别是______、______;加入稍过量的
操作A、B的名称分别是______、______;加入稍过量的![]() 溶液的作用是______。
溶液的作用是______。
![]() 写出在空气中充分加热煅烧
写出在空气中充分加热煅烧![]() 的化学方程式:______。
的化学方程式:______。
![]() 上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中
上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中![]() 的含量,进行如下实验:
的含量,进行如下实验:
![]() 称取样品
称取样品![]() ,加入足量稀
,加入足量稀![]() 溶解,并加水稀释至100mL;
溶解,并加水稀释至100mL;
![]() 量取
量取![]() 待测溶液于锥形瓶中;
待测溶液于锥形瓶中;
![]() 用酸化的
用酸化的![]() 标准液滴定至终点;
标准液滴定至终点;
![]() 重复操作b、
重复操作b、![]() 次,得出消耗
次,得出消耗![]() 溶液体积的平均值为
溶液体积的平均值为![]() 。
。
![]() 写出滴定过程中发生反应的离子方程式:______。
写出滴定过程中发生反应的离子方程式:______。
![]() 确定滴定达到终点的操作及现象为______。
确定滴定达到终点的操作及现象为______。
![]() 上述样品的质量分数为______。
上述样品的质量分数为______。
![]() 下列操作会导致样品中
下列操作会导致样品中![]() 的质量分数测定结果偏低的有______。
的质量分数测定结果偏低的有______。
![]() 未干燥锥形瓶
未干燥锥形瓶 ![]() 盛装标准液的滴定管没有用标准液润洗
盛装标准液的滴定管没有用标准液润洗
![]() 滴定结束时仰视刻度线读数
滴定结束时仰视刻度线读数![]() 量取待测液的滴定管没有润洗
量取待测液的滴定管没有润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧热的热化学方程式可表示为CH4(g)+202(g)=CO2(g)+2H2O(g) H=-890.3kJmol-1
B.500°C、30MPa下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为![]()
C.已知在120°C.101 kPa下,1 gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为![]()
D.25°C、101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJmol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO![]() 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
A.该温度高于25℃B.NaHSO4晶体的加入抑制了水的电离
C.由水电离出来的H+的浓度是1.0×10-10mol·L-1D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是
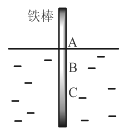
A.铁棒AB段发生反应为O2+ 4e-+ 2H2O = 4OH-
B.腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段
C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响
D.产生这种现象的本质原因是铁棒所处的化学环境不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是_______。
(2)滤渣A的成分是_______。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是_______ 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因_ 。

(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是_______。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:
Li4Ti5O12+ 3LiFePO4![]() Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12+ 3FePO4 该电池充电时阳极反应式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定大量共存的是( )
A. 含有AlO2-的溶液中:Na+ 、Al3+、Cl-、K+
B. 常温下由水电离出的c(H+)·c(OH-)=10-20 mol2·L-2的溶液中:Na+、NH![]() 、Cl-
、Cl-
C. 常温下 c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
D. 在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)置于一恒容密闭容器中,在不同温度下进行反应(已知该反应为放热反应)。实验记录得到下表中的两组数据:下列有关说法中不正确的是( )
实验序号 | 温度(℃) | 平衡常数(L/mol) | 起始量/mol | 平衡量/mol | 达到平衡所需时间(min) | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. 表中x=1.6;y=0.2B. 表中t>6
C. 表中K1、K2的关系:K2>K1D. 实验1在前6min的反应速率υ(SO2)=0.2mol/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com