
【题目】某学习小组在实验室中利用下图装置(夹持装置略去)测定某铁硫化物(FexSy)的组成,并探究反应后D装置所得溶液中含硫化合物的组成。

(一)硫化物(FexSy)的组成
实验步骤:
步骤Ⅰ 如图连接装置,检査装置气密性,装入药品;
步骤Ⅱ 打开分液漏斗旋塞,缓缓滴入水,并点燃酒精喷灯;
步骤Ⅲ 当硬质玻璃管中固体质量不再改变时,停止加热,继续通入—段时间的O2
步骤Ⅳ 实验结束后,将D中所得溶液加水配制成250 mL溶液;
……
请回答:
⑴仪器a的作用为______________________。
(2)步骤Ⅲ中,停止加热后还需继续通入一段时间的O2,其目的为__________________。
(3)步骤IV中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有___________________。
(4)取25. 00 mL步骤IV中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66g。则FexSy的化学式为___________________。
(5)问题讨论:有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案________(填“是”或“否”)合理,原因为_______________________。
(二)探究反应后D装置所得溶液中含硫化合物的组成。
理论推测:溶液中除含有Na2SO4外,还可能含有Na2SO3。
实验探究:滴定法测定溶液中Na2SO3的含量。
可供选择的试剂:①0.10 mol L-1 KMnO4酸性溶液 ②30%H2O2 ③0.10 mol L-1 KI淀粉溶液
(6)所选试剂为___________(填序号);所选试剂应装在_____________(填“酸式”或“碱式”)滴定管中。
(7)所利用的反应原理为__________________(用离子方程式表示)。
【答案】防止倒吸 使生成的SO2全部被NaOH溶液吸收 250 mL容量瓶、胶头滴管 FeS2 否 部分SO2被氧化,且空气中的CO2和水蒸气可能使干燥管增重 ① 酸式 2MnO4-+5SO32-+6H+= 5SO42-+2 Mn2++3H2O
【解析】
⑴生成的SO2被氢氧化钠溶液吸收,容易倒吸,因此仪器a的作用为防止倒吸。
(2)由于装置中有残留的SO2气体,因此步骤Ⅲ中,停止加热后还需继续通入一段时间的O2的目的为使生成的SO2全部被NaOH溶液吸收。
(3)步骤IV中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有250 mL容量瓶、胶头滴管。
(4)取25. 00 mL步骤IV中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66g,即硫酸钡是4.66g,硫酸钡物质的量是4.66g÷233g/mol=0.02mol,则根据S原子守恒可知化合物中S原子的物质的量是0.02mol×![]() =0.2mol,质量是0.2mol×32g/mol=6.4g,因此铁原子的质量是12g-6.4g=5.6g,n(Fe)=5.6g÷56g/mol=0.1mol,则n(Fe):n(S)=0.1mol:0.2mol=1:2,FexSy的化学式为FeS2。
=0.2mol,质量是0.2mol×32g/mol=6.4g,因此铁原子的质量是12g-6.4g=5.6g,n(Fe)=5.6g÷56g/mol=0.1mol,则n(Fe):n(S)=0.1mol:0.2mol=1:2,FexSy的化学式为FeS2。
(5)由于部分SO2被氧化,且空气中的CO2和水蒸气可能使干燥管增重,所以将装置D改为装有足量碱石灰的干燥管的方案不合理;
(6)由于Na2SO3具有还原性,KMnO4酸性溶液和H2O2都具有氧化性,且酸性高锰酸钾溶液显紫红色,不需要另加指示剂,所以所选试剂为0.10 mol ·L-1 KMnO4酸性溶液;KMnO4酸性溶液应装在酸式滴定管中。
(7)高锰酸钾具有氧化性,能氧化亚硫酸钠,方程式为2MnO4-+5SO32-+6H+=5SO42-+2 Mn2++3H2O。


科目:高中化学 来源: 题型:
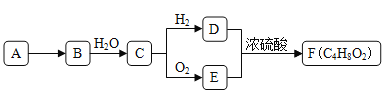
【题目】A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.06g·L-1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
请回答:
(1)有机物D中含有的官能团名称是__________________。
(2) D+E→F的反应类型是_________________________。
(3)有机物A在高温下转化为B的化学方程式是_________________。
(4)下列说法正确的是___。
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氢气和氧气反应生成1mol水蒸气放热241.8kJ,则反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH为( )
2H2O(g)的ΔH为( )
A.-483.6kJ·mol-1B.-241.8kJ·mol-1
C.-120.6kJ·mol-1D.+241.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有还原性 |
B | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,生成黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
C | 将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液,溶液变红 | 稀硫酸能氧化Fe2+ |
D | 向AgNO3溶液中滴加过量氨水,得到澄清溶液 | Ag+与NH3·H2O能大量共存 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 ℃时,将1 mol H2(g)和2 mol I2(g)充入到体积为1 L的密闭容器中,发生反应:I2(g)+H2(g) ![]() 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)=______,c(I2)=____,而c(HI)=____,所以化学反应速率____(填“V正”或“V逆”)最大,而_____(填“V正”或“V逆”)最小。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)___,c(I2)___,而c(HI)____,从而化学反应速率v(正)____,而v(逆)____。(均填“减小”、“增大”或“不变”。)
(3)当反应进行到v(正)与v(逆)____时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。当SO2、O2、SO3的浓度不再变化时,下列说法正确的是
2SO3(g)。当SO2、O2、SO3的浓度不再变化时,下列说法正确的是
A. 该反应已达化学平衡状态B. 正、逆反应速率相等且等于零
C. SO2和O2全部转化为SO3D. SO2、O2、SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是( )
CaO(s)+CO2(g),达到平衡,下列说法正确的是( )
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.增加CaCO3(s)的量,平衡正向移动
C.将体积增大为原来的2倍,再次达到平衡时,气体的密度不变
D.保持容器体积不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,是用氢氧燃料电池B进行的某电解实验:
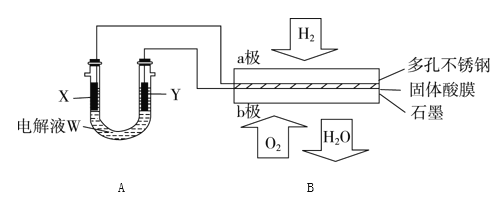
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:Li2NH+H2=LiNH2+LiH,则下列说法中正确的是________。
A. Li2NH中N的化合价是-1
B. 该反应中H2既是氧化剂又是还原剂
C. Li+和H-的离子半径相等
D. 此法储氢和钢瓶储氢的原理相同
(2)在电池B工作时:
①若用固体Ca(HSO4)2为电解质传递H+,则电子由________极流出,H+向______极移动(填“a”或“b ”)。
②b极上的电极反应式为_________。
③外电路中,每转移0.1 mol电子,在a极消耗________ L的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
①电解池中X极上的电极反应式是______________。在X极这边观察到的现象是____________。
②检验Y电极上反应产物的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种常见药物:①阿司匹林、②青霉素、③胃舒平、④麻黄碱。请回答下列问题。.
(1)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是_______(填序号)。
(2)滥用_______(填序号)药物会导致不良后果,若过量服用会引起中毒,应立即停药,并静脉注射![]() 溶液。
溶液。
(3)某同学胃酸过多,应选用的药物是______(填序号);抗酸药是治疗胃酸过多的一类药物,写出一种抗酸药中和胃酸的化学方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com