
【题目】在200 ℃时,将1 mol H2(g)和2 mol I2(g)充入到体积为1 L的密闭容器中,发生反应:I2(g)+H2(g) ![]() 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)=______,c(I2)=____,而c(HI)=____,所以化学反应速率____(填“V正”或“V逆”)最大,而_____(填“V正”或“V逆”)最小。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)___,c(I2)___,而c(HI)____,从而化学反应速率v(正)____,而v(逆)____。(均填“减小”、“增大”或“不变”。)
(3)当反应进行到v(正)与v(逆)____时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将____。
【答案】1 mol·L-1 2 mol·L-1 0 v(正) v(逆) 减小 减小 增大 减小 增大 相等 保持不变
【解析】
反应刚开始时,反应物氢气与碘蒸气的浓度最大,生成物的浓度为0,正反应速率最大,逆反应速率为0;随着反应的进行,反应物的浓度逐渐减小,生成物的浓度相应增大,正反应速率减小,逆反应速率增大;当反应的正、逆反应速率相等时,反应达到最大限度,此时反应混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率等都将保持不变。
(1)反应刚开始时,c(H2)= ![]() =1mol/L, c(I2)=
=1mol/L, c(I2)=![]() =2mol/L,c (HI)=0mol/L,所以正反应速率最大,逆反应速率最小为0,故答案为: 1 mol·L-1、2 mol·L-1、0、v(正)、v(逆);
=2mol/L,c (HI)=0mol/L,所以正反应速率最大,逆反应速率最小为0,故答案为: 1 mol·L-1、2 mol·L-1、0、v(正)、v(逆);
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为 c(H2)逐渐减小,c(I2)逐渐减小,而c(HI)逐渐增大,从而使化学反应速率v正逐渐减小,而v逆逐渐增大,故答案为:减小;减小;增大;减小;增大;
(3)当反应进行到v正与v逆 相等时,同一物质的消耗速率与生成速率,此反应就达到了平衡状态,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将保持不变,故答案为:相等;保持不变。


科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小, Y的次外层电子数是最外层的![]() ,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
,ZX是一种生氢剂,W与Y同一主族。下列叙述正确的是( )
A. 原子半径:rW>rZ>rY
B. 化合物ZX中各原子均满足8电子稳定结构
C. 由X、Y、Z、W组成的化合物的水溶液可能显酸性
D. 简单气态氢化物稳定性:W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇的化学方程式为:CO(g)+2H2(g)CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
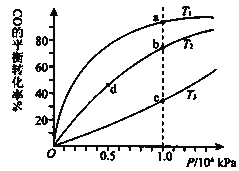
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量M(a)<M(c) M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是

A. 甲、乙的化学式均为C8H14
B. 乙的二氯代物共有7种(不考虑立体异构)
C. 丙的名称为乙苯,其分子中所有碳原子可能共平面
D. 甲、乙、丙均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
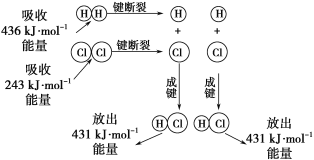
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室中利用下图装置(夹持装置略去)测定某铁硫化物(FexSy)的组成,并探究反应后D装置所得溶液中含硫化合物的组成。

(一)硫化物(FexSy)的组成
实验步骤:
步骤Ⅰ 如图连接装置,检査装置气密性,装入药品;
步骤Ⅱ 打开分液漏斗旋塞,缓缓滴入水,并点燃酒精喷灯;
步骤Ⅲ 当硬质玻璃管中固体质量不再改变时,停止加热,继续通入—段时间的O2
步骤Ⅳ 实验结束后,将D中所得溶液加水配制成250 mL溶液;
……
请回答:
⑴仪器a的作用为______________________。
(2)步骤Ⅲ中,停止加热后还需继续通入一段时间的O2,其目的为__________________。
(3)步骤IV中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有___________________。
(4)取25. 00 mL步骤IV中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66g。则FexSy的化学式为___________________。
(5)问题讨论:有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案________(填“是”或“否”)合理,原因为_______________________。
(二)探究反应后D装置所得溶液中含硫化合物的组成。
理论推测:溶液中除含有Na2SO4外,还可能含有Na2SO3。
实验探究:滴定法测定溶液中Na2SO3的含量。
可供选择的试剂:①0.10 mol L-1 KMnO4酸性溶液 ②30%H2O2 ③0.10 mol L-1 KI淀粉溶液
(6)所选试剂为___________(填序号);所选试剂应装在_____________(填“酸式”或“碱式”)滴定管中。
(7)所利用的反应原理为__________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某样品中含有碳酸钠及少量的硫酸钠和氯化钠。某学生为了检验其成分,按照下图所示步骤进行实验,请将所加试剂及有关结论填写在相应的空格中。 ____________、__________、_____________、_____________、______________、_______________
____________、__________、_____________、_____________、______________、_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体中可能含有K+、NH4+、Mg2+、Fe3+、Ba2+、Cu2+、Cl-、SO42-、HCO3-中的几种,填写下列空白:
(1)将该固体溶于水后得无色澄清溶液,由此现象得出该固体中一定不存在的离子是___;
(2)将所得无色澄清溶液进行检测,实验步骤及现象如图:

图中实验中得到的两种气体分别是___、___;白色沉淀成分是___ (填化学式);加入足量盐酸生成气体的离子方程式为___;该固体中可能存在的离子是___;
(3)通过以上检测,下列说法正确的是___
A.该固体中可能含有(NH4)2SO4、KHCO3
B.该固体中可能含有K2SO4、NH4HCO3,一定不含KCl
C.该固体中可能含有(NH4)2SO4、KCl,一定不含KHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com