
【题目】短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置_____________________,
E的原子结构示意图是________。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是____(填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式____。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为____,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为___________。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式___________________________________。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
物质 | Fe(OH)2 | Fe(OH)3 |
Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于____mol·L-1。
【答案】第二周期ⅥA族 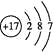 BCD
BCD 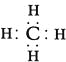 NH4HCO3 或(NH4)2CO3 H2NCH2COOH Fe2++2Fe3++8NH3+8H2OFe(OH)2↓+2Fe(OH)3↓+8NH4+ 10-12
NH4HCO3 或(NH4)2CO3 H2NCH2COOH Fe2++2Fe3++8NH3+8H2OFe(OH)2↓+2Fe(OH)3↓+8NH4+ 10-12
【解析】
根据A、D可形成的两种液态化合物的情况知,这两种化合物为H2O和H2O2,再结合原子序数增大,所以A为H,D为O,则B只能为C,C为N,E单质可净化水质,E为Cl。
(1)N与O两元素原子得电子能力强弱即非金属性强弱的判断依据有气态氢化物的稳定性、最高价酸的酸性、形成气态氢化物的难易程度、两种元素所形成的化合物中的化合价等。
(2)由A、B两种元素组成的最简单的化合物是甲烷。
(3)既可以与盐酸反应又可以与NaOH溶液反应的化合物通常为两性物质、弱酸酸式盐、弱酸的铵盐以及氨基酸。
(4)①将化合物NH3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成的两种碱应为Fe(OH)2和Fe(OH)3。
(5)根据Fe(OH)2和Fe(OH)3的Ksp计算c(OH-)。
(1)O的原子序数是8,位于第二周期ⅥA族;氯元素位于第三周期ⅦA族,所以原子结构示意图为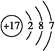 ;由气态氢化物的沸点无法确定元素的非金属性强弱。答案选BCD。
;由气态氢化物的沸点无法确定元素的非金属性强弱。答案选BCD。
(2)由A、B两种元素组成的最简单的化合物是甲烷,电子式为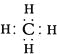 。
。
(3)都既可以与盐酸反应又可以与NaOH溶液反应,一般是弱酸的酸式盐或弱酸的铵盐或氨基酸,因此甲是碳酸氢铵或碳酸铵,乙是甘氨酸。化学式分别是NH4HCO3 或(NH4)2CO3、H2NCH2COOH。
(4)①根据原子守恒可知,两种碱应该是氢氧化铁和氢氧化亚铁,所以方程式为Fe2++2Fe3++8NH3+8H2OFe(OH)2↓+2Fe(OH)3↓+8NH4+。
(5)亚铁离子和铁离子的浓度分别是2.0 mol·L-1和4.0 mol·L-1,所以根据溶度积常数可知,相应OH-浓度分别是10-8mol·L-1、10-12mol·L-1,所以混合液中c(OH-)不得大于10-12mol·L-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室用 ![]() 还原
还原 ![]() 制备金属 W的装置如下图所示
制备金属 W的装置如下图所示![]() 粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气
粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气![]() ,下列说法错误的是
,下列说法错误的是![]()
![]()
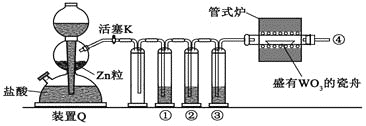
A.反应开始时,先加热管式炉,再打开活塞 K
B.往盐酸中加入少量 ![]() ,可加快产生
,可加快产生 ![]() 的速率
的速率
C.管式炉加热前,用试管在![]() 处收集气体并点燃,通过声音判断气体纯度
处收集气体并点燃,通过声音判断气体纯度
D.装置 ![]() 启普发生器
启普发生器![]() 也可用于石灰石与盐酸反应制二氧化碳
也可用于石灰石与盐酸反应制二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是两个实验装置(铁架台等辅助仪器略去未画)。
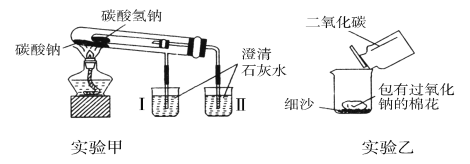
回答下列问题:
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是________(填“Ⅰ”或“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是_________, 通过实验甲可比较出________(填“Na2CO3”或“NaHCO3”)更稳定。
(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象:包有Na2O2的棉花着火燃烧。棉花能着火燃烧,说明该反应特点是________。
(3)取10.0 g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0 g。则原混合物中碳酸钠的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol H2O2放出热量98kJ,在含少量I- 的溶液中,H2O2分解的机理为①H2O2+I-→H2O+IO-(慢)、② H2O2+IO-→H2O+O2+I-(快)。下列有关该反应的说法不正确的是( )
A.过氧化氢分解快慢决定于反应慢的①
B.![]() 的分解速率与的
的分解速率与的![]() 浓度有关
浓度有关
C.该反应的催化剂是![]() ,而不是
,而不是![]()
D.由于催化剂的加入降低了反应的活化能,也改变了该反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。
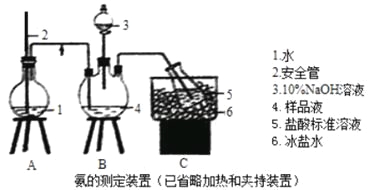
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将___(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是___________;滴定终点时,若溶液中c(Ag+)=2.0×10—5mol·L—1,c(CrO42—)为______mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为______,制备X的化学方程式为____________________;X的制备过程中温度不能过高的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为电解饱和食盐水装置,下列有关说法不正确的是

A. 左侧电极上发生氧化反应
B. 右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝
C. 电解一段时间后,B口排出NaOH溶液
D. 电解饱和食盐水的离子方程式: 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).
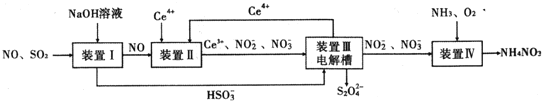
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式______.
(2)含硫各微粒(H2SO3、![]() 和
和![]() )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示.
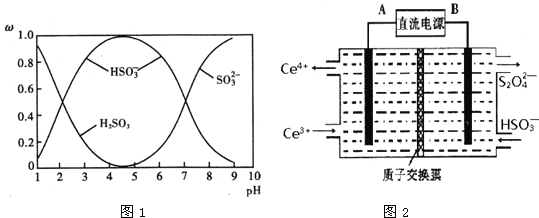
①下列说法正确的是______(填标号).
A.pH=7时,溶液中c(Na+)=3c(![]() )
)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(![]() )+c(H2SO3)
)+c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为______.
③取装置Ⅰ中的吸收液VmL,用cmol/L的酸性高锰酸钾溶液滴定,酸性高锰酸钾溶液应装在______(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是______
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如图2所示.图中A为电源的______(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为______.
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为 0.4mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为______ L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,1 mol浓硝酸与足量Al反应,转移电子数为3NA
B.标准状况下,5.6 L Cl2完全溶解于水配成1 L溶液,溶液中Cl-数为0.5NA
C.20 gH218O含有的中子数为10NA
D.1 L 0.5 mol·L-1 Al2(SO4)3溶液中阳离子所带电荷数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析错误的是( )
A.镓元素为第四周期第ⅢA元素
B.原子半径:Br>Ga
C.79Br与81Br得电子能力相同
D.碱性:Ga(OH)3>Al(OH)3,酸性:HClO4>HBrO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com