
【题目】下图是两个实验装置(铁架台等辅助仪器略去未画)。
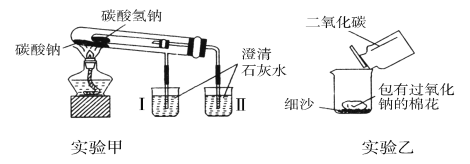
回答下列问题:
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是________(填“Ⅰ”或“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是_________, 通过实验甲可比较出________(填“Na2CO3”或“NaHCO3”)更稳定。
(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象:包有Na2O2的棉花着火燃烧。棉花能着火燃烧,说明该反应特点是________。
(3)取10.0 g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0 g。则原混合物中碳酸钠的质量分数为________。
【答案】Ⅱ Ca2++2OH-+CO2=CaCO3↓+H2O Na2CO3 该反应放出大量的热 32.8%
【解析】
碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,二氧化碳能使澄清的石灰水变浑浊;
Na2O2与CO2反应生成和碳酸钠和氧气,燃烧的条件:可燃物,与氧气或空气接触、温度达到着火点,三者必须同时满足;
生成的沉淀为碳酸钙,根据关系式:2NaHCO3~CO2~CaCO3计算混合物中NaHCO3的质量,进而可计算出混合物中碳酸钠的质量,碳酸钠的质量分数=碳酸钠的质量混合物的质量×100%。
(1)NaHCO3受热易分解,产生CO2:2NaHCO3![]() Na2CO3+CO2↑+H2O,能使澄清石灰石变浑浊,故产生沉淀的烧杯是Ⅱ;该烧杯中发生反应的离子方程式是:Ca2++2OH-+CO2=CaCO3↓+H2O;Na2CO3受热不分解,烧杯Ⅰ中澄清石灰水不变浑浊,通过实验甲可比较出Na2CO3更稳定,
Na2CO3+CO2↑+H2O,能使澄清石灰石变浑浊,故产生沉淀的烧杯是Ⅱ;该烧杯中发生反应的离子方程式是:Ca2++2OH-+CO2=CaCO3↓+H2O;Na2CO3受热不分解,烧杯Ⅰ中澄清石灰水不变浑浊,通过实验甲可比较出Na2CO3更稳定,
故答案为:Ⅱ ;Ca2++2OH-+CO2=CaCO3↓+H2O ; Na2CO3 ;
(2)Na2O2与CO2反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,并放出大量的热,故能够使棉花着火,
故答案为:该反应放出大量的热;
(3)生成的沉淀为碳酸钙,则:
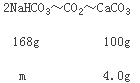
![]() =
=![]() ,解得m=6.72g;
,解得m=6.72g;
m(Na2CO3)=10.0g-6.72g=3.28g,故其质量分数为:3.28g÷10.0g×100%=32.8%,
故答案为:32.8%。


科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 电解饱和食盐水可制取烧碱、氯气、氢气
B. 从海水中可提取镁、溴、碘等物质
C. 粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+
D. 在镀件上镀铜,镀件作阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。
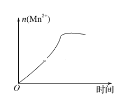
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于工业生产说法正确的是![]()
A.氯碱工业中的阳离子交换膜阻止阳离子通过
B.在硫酸工业、合成氨工业、硝酸工业中,均必须对尾气进行吸收处理
C.工业上均用电解熔融氧化物的方法制金属镁和铝
D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最新发现,通过简单的化学反应,可以将树木纤维素转变成超级储能装置,如图是该反应的微观示意图,下列说法错误的是
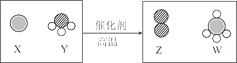
![]()
![]()
![]()
![]()
A.物质W中碳元素的质量分数为75%
B.化学反应前后原子的种类、个数、质量均保持不变
C.参加反应的 X、Y 的物质的量之比为3:4
D.物质Y为NH3,其电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 R、T、Q、W 在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )

A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含 T 的盐溶液一定能电离出 T 的阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置_____________________,
E的原子结构示意图是________。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是____(填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式____。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为____,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为___________。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式___________________________________。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
物质 | Fe(OH)2 | Fe(OH)3 |
Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的相互转化关系如 下图所示(反应条件未标出),其中反应①是置换反应。
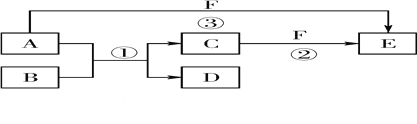
(1)若A是常见的金属单质,D、F是气态单质,反应① 在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是__________。
(2)若B、C、F都是气态单质,且B有毒,③的反应中还有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则A、D反应产物的电子式是________,反应③的化学方程式是____。
(3)若A、D、F都是短周期元素组成的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com