
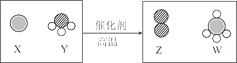
【题目】科学家最新发现,通过简单的化学反应,可以将树木纤维素转变成超级储能装置,如图是该反应的微观示意图,下列说法错误的是
![]()
![]()
![]()
![]()
A.物质W中碳元素的质量分数为75%
B.化学反应前后原子的种类、个数、质量均保持不变
C.参加反应的 X、Y 的物质的量之比为3:4
D.物质Y为NH3,其电子式为![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在1200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2 O2(g)═SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)═3/2 S2(g)+2H2O(g) △H2
H2S(g)+1/2 O2(g)═S(g)+H2O(g) △H3
2S(g)═S2(g) △H4
则△H4的正确表达式为( )
A.△H4=3/2(△H1-△H2-3△H3)B.△H4=2/3 (3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)D.△H4=2/3 (△H1+△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含![]() 、ZnS、CuS及少量的
、ZnS、CuS及少量的![]() 。某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是
。某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是
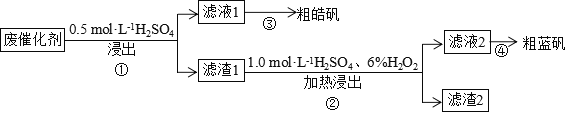
A.滤液1中是否含有![]() ,可以选用KSCN和新制的氯水检验
,可以选用KSCN和新制的氯水检验
B.步骤![]() 操作中,先加
操作中,先加![]()
![]() ,在不断搅拌下,再加入
,在不断搅拌下,再加入![]()
![]()
C.滤渣1成分是![]() 和CuS,滤渣2成分一定是
和CuS,滤渣2成分一定是![]()
D.步骤![]() 操作中,生成的气体需用NaOH溶液或
操作中,生成的气体需用NaOH溶液或![]() 溶液吸收
溶液吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是

A. A、B之间任意一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是两个实验装置(铁架台等辅助仪器略去未画)。
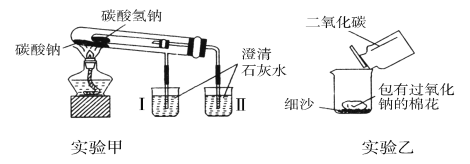
回答下列问题:
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是________(填“Ⅰ”或“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是_________, 通过实验甲可比较出________(填“Na2CO3”或“NaHCO3”)更稳定。
(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象:包有Na2O2的棉花着火燃烧。棉花能着火燃烧,说明该反应特点是________。
(3)取10.0 g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0 g。则原混合物中碳酸钠的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )
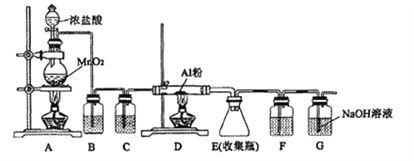
A. B装置中所装试剂为饱和的NaCl溶液,其作用是除去氯气中的HCl
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol H2O2放出热量98kJ,在含少量I- 的溶液中,H2O2分解的机理为①H2O2+I-→H2O+IO-(慢)、② H2O2+IO-→H2O+O2+I-(快)。下列有关该反应的说法不正确的是( )
A.过氧化氢分解快慢决定于反应慢的①
B.![]() 的分解速率与的
的分解速率与的![]() 浓度有关
浓度有关
C.该反应的催化剂是![]() ,而不是
,而不是![]()
D.由于催化剂的加入降低了反应的活化能,也改变了该反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为电解饱和食盐水装置,下列有关说法不正确的是

A. 左侧电极上发生氧化反应
B. 右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝
C. 电解一段时间后,B口排出NaOH溶液
D. 电解饱和食盐水的离子方程式: 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol·L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是
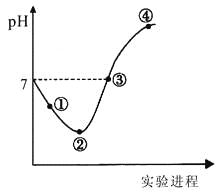
A.曲线起点处水的电离程度最大,可用pH试纸测定溶液pH
B.②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO-
C.氯气~氯水体系中:c(H+)=c(Cl2) +c(HClO)+c(ClO-)
D.③点所示溶液中:c(Na+) = c(Cl-)+c(ClO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com