

| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |


科目:高中化学 来源:不详 题型:单选题
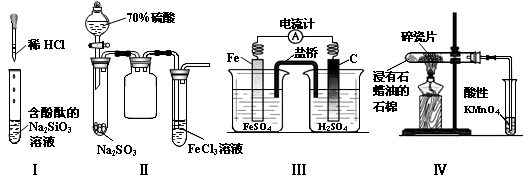
| A.实验Ⅰ试管中红色溶液逐渐变成无色溶液 |
| B.实验Ⅱ试管中出现淡黄色浑浊 |
| C.实验Ⅲ铁棒上有无色气泡产生 |
| D.实验Ⅳ中酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 CuO + SO3↑ 2SO3
CuO + SO3↑ 2SO3  2SO2↑+ O2↑
2SO2↑+ O2↑
 2SO2(g) + O2(g)的平衡常数表达式为K= 。
2SO2(g) + O2(g)的平衡常数表达式为K= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 |
| B.欲除去蛋白质溶液中的NaCl而又不改变其性质,可加入适量BaCl2溶液后过滤 |
| C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D.为了证明焦炉气中含有氢气,可将焦炉气通过灼热的氧化铜粉末,看黑色粉末是否变红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲=乙=丙 | B.丙>乙>甲 | C.乙>丙>甲 | D.甲=丙>乙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
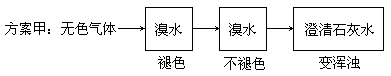
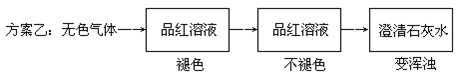
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 E.双氧水 F.硝酸银 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol·L-1 | B.0.045mol·L-1 | C.0.029mol·L-1 | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入2滴酚酞。 |
| B.用待测定的溶液润洗酸式滴定管 |
| C.用蒸馏水洗干净滴定管 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至 刻度“0”或“0”刻度以下 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com