
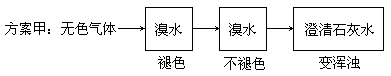
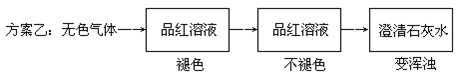
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用锌与稀硝酸制备H2 |
| B.用酸性KMnO4溶液鉴别1-戊烯和甲苯 |
| C.用丁达尔效应鉴别鸡蛋白溶液和食盐水 |
| D.用水来除去NO2中少量的NO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
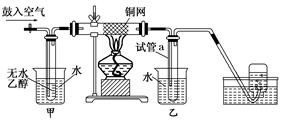
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
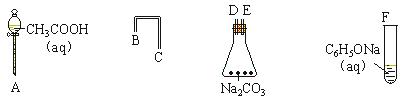
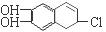 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是 mol和 mol。
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是 mol和 mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
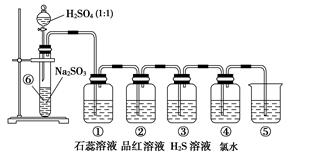
| 装置 | 实验现象 | 体现SO2的性质 |
| ① | | |
| ② | | |
| ③ | | |
| ④ | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
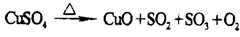
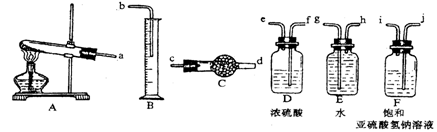
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com