
【题目】化合物M可用于消毒剂、抗氧化剂、医药中间体。实验室由芳香烃A制备M的一种合成路线如下:

请回答:
(1)B的化学名称为___________;D中官能团的名称为______________________。
(2)由F生成G的反应类型为___________;F的分子式为___________。
(3)由E转化为F的第一步反应的化学方程式为______________________。
(4)M的结构简式为___________。
(5)芳香化合物Q为C的同分异构体,Q能发生银镜反应,其核磁共振氢谱有4组吸收峰。写出符合要求的Q的一种结构简式______________________。
(6)参照上述合成路线和信息,以苯甲酸乙酯和CH3MgBr为原料(无机试剂任选),设计制备 的合成路线_________________________________。
的合成路线_________________________________。
【答案】对甲基苯甲醛(或4﹣甲基苯甲醛) 羧基、氯原子 酯化反应或取代反应 C8H12O2 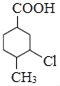 +2NaOH
+2NaOH![]()
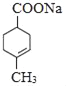 +NaCl+2H2O
+NaCl+2H2O 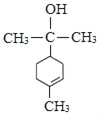
![]() 或
或![]() ;
; 
![]()
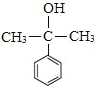
![]()
![]()
【解析】
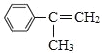
A的分子式为C7H8,结合B的结构,应是A与CO发生加成反应生成B(对甲基苯甲醛),可知A为![]() 。对比B与C的结构,结合反应条件、C的分子式,可知B中醛基氧化为羧基得到C,C与氯气发生苯环上取代反应生成D,D与氢气发生加成反应生成E,E发生取代反应生成F,故C为
。对比B与C的结构,结合反应条件、C的分子式,可知B中醛基氧化为羧基得到C,C与氯气发生苯环上取代反应生成D,D与氢气发生加成反应生成E,E发生取代反应生成F,故C为![]() 、D为
、D为![]() 、E为
、E为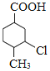 。F与乙醇发生酯化反应生成G为
。F与乙醇发生酯化反应生成G为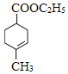 ,G发生信息中反应生成M为
,G发生信息中反应生成M为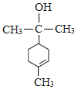 ,据此分析解答。
,据此分析解答。
(1)B的结构简式为![]() ,名称为对甲基苯甲醛(或4﹣甲基苯甲醛);D为
,名称为对甲基苯甲醛(或4﹣甲基苯甲醛);D为 ,其中 官能团有羧基、氯原子,故答案为:对甲基苯甲醛(或4﹣甲基苯甲醛);羧基、氯原子;
,其中 官能团有羧基、氯原子,故答案为:对甲基苯甲醛(或4﹣甲基苯甲醛);羧基、氯原子;
(2)由F生成G发生酯化反应,也属于取代反应;F的分子式为C8H12O2,故答案为:酯化反应或取代反应;C8H12O2;
(3)由E转化为F的第一步反应的化学方程式为: +2NaOH
+2NaOH![]()
 +NaCl+2H2O,故答案为:
+NaCl+2H2O,故答案为: +2NaOH
+2NaOH![]()
 +NaCl+2H2O;
+NaCl+2H2O;
(4)由分析可知M的结构简式为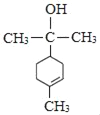 ,故答案为:
,故答案为: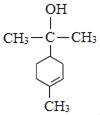 ;
;
(5)芳香化合物Q为C(![]() )的同分异构体,Q能发生银镜反应,说明含有醛基或甲酸形成的酯基,其核磁共振氢谱有4组吸收峰。符合要求的Q的结构简式为:
)的同分异构体,Q能发生银镜反应,说明含有醛基或甲酸形成的酯基,其核磁共振氢谱有4组吸收峰。符合要求的Q的结构简式为:![]() 、
、![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
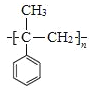
(6) 加聚反应得到
加聚反应得到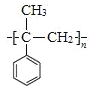 ,
,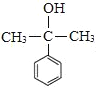 发生消去反应得到
发生消去反应得到 ,由信息可知苯甲酸乙酯与①CH3MgBr、②H+/H2O作用得到
,由信息可知苯甲酸乙酯与①CH3MgBr、②H+/H2O作用得到 ,合成路线流程图为
,合成路线流程图为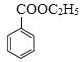
![]()

![]()

![]()
 ,故答案为:
,故答案为:
![]()

![]()

![]()
 。
。


科目:高中化学 来源: 题型:
【题目】某课外兴趣小组设计利用废旧干电池中的锌皮和未知浓度的稀盐酸制取纯净、干燥的氢气,并验证气体中是否含有杂质。实验装置图如图:
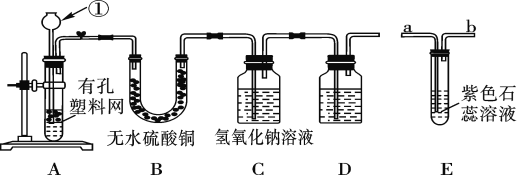
(查阅资料)无水硫酸铜遇水变蓝色。
(1)装置A中仪器①的名称是____;写出发生反应的化学方程式:___。
(2)实验中看到B中无水硫酸铜变蓝色,说明产生的气体中含有杂质水。为了检验气体中还可能存在的杂质,可将E装置连接到上述装置____(填序号)之间,气体从____(填“a”或“b”) 进入装置E。
(3)D装置中的试剂是_____(写出名称)。
(4)下列收集氢气的方法中符合题意的是_____。
A.排水法 B.向下排空气法 C.干瘪的塑料袋 D.塑料瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸松油酯是松油醇的酯化产物,具有甜香气味,广泛应用于日用和食用香精中。乙酸松油酯的结构简式如图甲所示,下列说法正确的是

A. 乙酸松油酯的分子式为C12H22O2
B. 乙酸松油酯的水解产物松油醇与图乙所示物质互为同分异构体
C. 乙酸松油酯既易溶于水、也易溶于乙醇或油脂
D. 乙酸松油酯能使Br2的CCl4溶液或酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(2)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(4)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:![]()
![]()
![]()
① 若在上述反应中有30 %的氧气转化为臭氧,所得混合气的平均摩尔质量为________![]() (保留一位小数)
(保留一位小数)
②将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为__________L
③实验室将氧气和臭氧的混合气体0.896L (标准状况)通入盛有20.0g铜粉的反应器中,充分加热后(气态全部参加反应),粉末的质量变为21.6g,则原混合气中臭氧的体积分数为__________,该混合气体对氢气的相对密度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)===2CO2(g) ΔH2
2H2(g)+O2(g)===2H2O(g) ΔH3
则反应CO(g)+2H2(g)===CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。

③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不再发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g) ![]() CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。

0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g)
CH3OH(g)的平衡常数K=__________。相同温度下,在一个恒容容器中加入一定量的CO(g)和H2发生:CO(g)+2H2(g) ![]() CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
CH3OH(g)的反应,某时刻测得体系中各物质的量浓度如下:C(CO)=0.25 mol·L-1,C(H2)=1.0 mol·L-1,C(CH3OH)=0.75 mol·L-1,则此时该反应_____进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质属于强电解质的是______;属于弱电解质的是_______;属于非电解质的是_______.
①CH3COOH ②BaSO4 ③石墨 ④NaCl水溶液 ⑤盐酸 ⑥蔗糖 ⑦CO2 ⑧Na2O ⑨H2CO3 ⑩氢氧化铝
(2)写出CH3COOH 、H2CO3 、氢氧化铝的电离方程式______________________________; __________________________________;________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八十年代,我国化学家打破了西方国家对维生素C的垄断,发明的“两段发酵法”大大降低了生产成本。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:

下列说法正确的是
A. 上述反应为取代反应
B. 维生素C水解得到2种产物
C. 维生素C有酯基不能溶于水,可溶于有机溶剂
D. 该反应表明维生素C具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25℃时,体积均为20mL浓度均为0.1mol·L-1的两种酸HX、HY溶液中分別滴加0.1mol·L-1的NaOH溶液所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是

A. HX、HY均为弱酸
B. Ka(HY)的数量级约为10-6
C. b点时:2c(Na+)=c(Y-)+c(HY)
D. V(NaOH)=20mL时,反应后的两种溶液中c(X-)=c(Y-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com