
【题目】某课外兴趣小组设计利用废旧干电池中的锌皮和未知浓度的稀盐酸制取纯净、干燥的氢气,并验证气体中是否含有杂质。实验装置图如图:
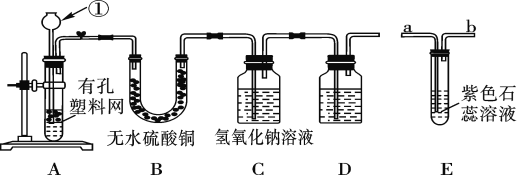
(查阅资料)无水硫酸铜遇水变蓝色。
(1)装置A中仪器①的名称是____;写出发生反应的化学方程式:___。
(2)实验中看到B中无水硫酸铜变蓝色,说明产生的气体中含有杂质水。为了检验气体中还可能存在的杂质,可将E装置连接到上述装置____(填序号)之间,气体从____(填“a”或“b”) 进入装置E。
(3)D装置中的试剂是_____(写出名称)。
(4)下列收集氢气的方法中符合题意的是_____。
A.排水法 B.向下排空气法 C.干瘪的塑料袋 D.塑料瓶
【答案】长颈漏斗 Zn+2HCl=ZnCl2+H2↑ BC a 浓硫酸 C
【解析】
(1)装置A是主发生装置,锌皮与盐酸在此处反应;
(2)从发生装置出来的气体中可能含有酸性气体氯化氢,可用紫色石蕊溶液检验。但其检验装置应放在氢氧化钠溶液之前,气体通入时遵循“长进短出”;
(3)在除去氯化氢之后,要对气体进行干燥;
(4)排气法收到的气体不纯净,排水法收到的气体不干燥,本实验目的是收集到干燥的氢气,一一分析所给的方法进行排除。
(1)装置A中仪器①为长颈漏斗,发生反应的化学方程式为Zn+2HCl=ZnCl2+H2↑;
(2)盐酸具有挥发性,所以生成的氢气中必带有少量的氯化氢气体杂质,因氯化氢能与NaOH反应,所以必须放在NaOH溶液之前,水分通常需要在通过其它溶液前先检验,所以该装置放在B装置之后,C装置之前;
(3)因实验目的是要收集干燥的氢气,所以D装置中需要装入干燥剂,此处选择浓硫酸;
(4)依据本实验的目的是为了获取干燥纯净的气体来分析判断。
A.用排水法收集的气体不干燥,A项排除;
B.用向下排空气法可以获得氢气,但不够纯净(不可能将空气排尽,气体中有空气混入),B项排除;
C.较为合理,因为干瘪,所以没有空气混入,C项正确;
D.排气法的自身缺点使收得的气体不纯,D项排除;
所以答案选择C项。


科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A. Ka(HA)的数量级为10-5
B. 当NaOH溶液与HB混合至中性时:c(B-)<c(HB)
C. 等浓度的NaA、NaB溶液中,水的电离程度:NaA<NaB
D. 等浓度的HB和NaA的混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 室温下,1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
B. 25℃时,0.1mol L-1的HA溶液中![]() = 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
= 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
C. 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大
D. 25℃时,BaSO4在水中有沉淀和溶解的平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq),说明BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 25℃时,pH=1的盐酸溶液中,由水电离出的H+个数为10-13NA
B. 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA
C. 1L0.1molL-1NaHCO3溶液中含有0.1NA个HCO3-
D. 100gCaCO3与KHCO3的混合物中含有的阴离子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知SO2(g)+ 1/2 O2(g) ![]() SO3(g) △H = -98.30kJ/mol,现将4molSO2与一定量O2混合后充分反应,当放出314.56kJ热量时,SO2的转化率为_________________。
SO3(g) △H = -98.30kJ/mol,现将4molSO2与一定量O2混合后充分反应,当放出314.56kJ热量时,SO2的转化率为_________________。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_____________________________
(3)在一定条件下,CH4 和CO的燃烧的热化学方程式分别为:
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H = -890 kJ/mol
2CO ( g ) + O2 ( g ) = 2CO2 ( g ) △H = -566 kJ/mol
一定量的CH4和CO的混合气体完全燃烧时,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀。求混合气体中CH4 和CO的体积比_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-环氧丁烷结构简式如图,通常为无色液体,用于制造泡沫塑料、合成橡胶、非离子型表面活性剂等。下列关于1,2-环氧丁烷的说法不正确的是
![]()
A. 化学式为C4H8O
B. 氧原子与所有碳原子可能处于同一平面
C. 能发生氧化反应和取代反应
D. 二溴代物的结构有9种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M可用于消毒剂、抗氧化剂、医药中间体。实验室由芳香烃A制备M的一种合成路线如下:

请回答:
(1)B的化学名称为___________;D中官能团的名称为______________________。
(2)由F生成G的反应类型为___________;F的分子式为___________。
(3)由E转化为F的第一步反应的化学方程式为______________________。
(4)M的结构简式为___________。
(5)芳香化合物Q为C的同分异构体,Q能发生银镜反应,其核磁共振氢谱有4组吸收峰。写出符合要求的Q的一种结构简式______________________。
(6)参照上述合成路线和信息,以苯甲酸乙酯和CH3MgBr为原料(无机试剂任选),设计制备 的合成路线_________________________________。
的合成路线_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com