
【题目】常温下,将pH和体积均相同的HNO2和CH3COOH溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
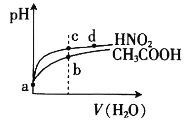
A.电离平衡常数:Ka(CH3COOH)>Ka(HNO2)
B.从c点到d点,溶液中 的值保持不变
的值保持不变
C.溶液中水的电离程度:b>c
D.a点时,相同体积的两溶液分别与NaOH恰好中和后,溶液中的n(Na+)相等
【答案】B
【解析】
A. 酸的酸性越强,电离平衡常数越大;
B. 电离平衡常数之与温度有关;
C. 酸能抑制水的电离,H+浓度越大,抑制程度就越大;
D. a点时同体积的两种酸,H+浓度相同,但n(HNO2)<n(CH3COOH),据此分析作答。
A. 根据图像可知酸性HNO2>CH3COOH,酸的酸性越强,电离平衡常数越大,因此Ka(HNO2) > Ka(CH3COOH),A项错误;
B. 电离平衡常数之与温度有关,温度不变电离平衡常数不变,c、d两点所处的温度相同,因此溶液中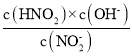 的值保持不变,B项正确;
的值保持不变,B项正确;
C. 酸性HNO2>CH3COOH,HNO2电离出的H+浓度大于CH3COOH电离出的H+浓度,H+浓度越大,抑制程度就越大,因此水的电离程度:c>b,C项错误;
D. a点时同体积的两种酸,H+浓度相同,但n(HNO2)<n(CH3COOH),因此CH3COOH反应时消耗的NaOH更多,溶液中的n(Na+)不相等,D项错误;
答案选B。


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为![]() )为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
)为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
(1)步骤④为冶炼金属铝的过程,应选择的方法是______(填序号)。
A.以C、![]() 或
或![]() 作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
(2)步骤③所涉及反应的化学方程式为_____________________________________________。
(3)步骤①所涉及反应的离子方程式为_________________________________________________。
(4)步骤②至步骤③的过程中,须经过_____操作。
(5)步骤②所得溶液中含有的大量阴离子是________________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将石油分馏得到的重油进行裂化可以获得较多的轻质燃油。某研究性学习小组模拟工业.上石油的催化裂化设计了如图所示实验装置。实验过程中可观察到烧瓶中固体石蜡先熔化,试管II中有少量液体生成,试管巩中酸性高锰酸钾溶液褪色,实验后闻试管II中液体的气味,发现其具有汽油的气味。

资料一 石蜡是含有20 ~ 30个碳原子的烷烃组成的混合物,常温下呈固态。
资料二 石油催化裂化过程中通常使用![]() 作催化剂。
作催化剂。
(1)为保证实验成功,实验前必须进行的操作是_________________;装置中长导管的作用是________________________。
(2)试管II中有少量液体生成说明________________。
(3)试管III中溶液褪色说明_______________________。
(4)_______(填“能”或“不能”)用试管II中的液体萃取溴水中的溴,理由是___________。
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式:___________________________。
(6)石油裂化的主要目的是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
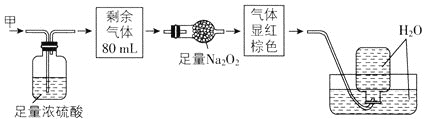
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1 盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是______,______。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?为什么?__________。
(3)他们记录的实验数据如下:已知:![]()
①计算完成下表。(保留小数点后一位)
序号 | 实验用品 | 溶液温度 | 温度差平均值 | ||
t 1 | t 2 | ||||
1 | 50 mL0.55mol·LNaOH | 50 mL0.5mol·LHCl | 20℃ | 23.3℃ | _____ |
2 | 50 mL0.55mol·LNaOH | 50 mL0.5mol·LHCl | 20℃ | 23.5℃ | |
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:______________。
(4)若用KOH代替NaOH,对测定结果________(填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将________(填“变大”或“变小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,生成的有机物只有一种的是
A.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
B.新戊烷和氯气发生取代反应生成一氯取代物的反应
C.苯酚与浓溴水发生取代反应生成一溴苯酚的反应
D.异戊烷和氯气发生取代反应生成一氯取代物的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解;②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。下面是制取少量S2Cl2的装置,回答下列问题:
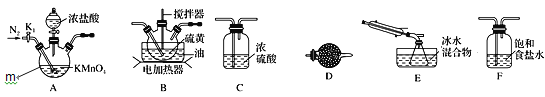
(1)仪器m的名称为______。
(2)S2Cl2的电子式为______。
(3)装置连接顺序:______→E→D。
(4)为了提高S2Cl2的纯度,实验的关键是控制好温度和________。
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状 且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式_______。
(6)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数设计了如下实验方案:
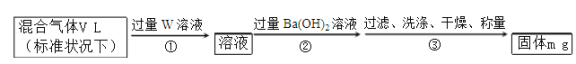
该混合气体中气体X的体积分数为_____(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图),下列对于试管内发生的反应及现象的说法正确的是( )
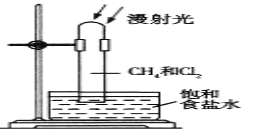
A. 反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生
B. 将该装置放在黑暗处,![]() 与
与![]() 也能反应
也能反应
C. 该反应仅得到一种有机产物
D. ![]() 和
和![]() 完全反应后液面上升,液体充满试管
完全反应后液面上升,液体充满试管
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com