
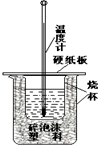
 化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛.
化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛.| 1 |
| 2 |


 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
| A、等于1.3mol |
| B、小于1.3mol |
| C、大于1.4mol |
| D、等于1.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P4和CO2分子中都只含有共价键 |
| B、CCl4和NH3的分子的立体结构都是正四面体形 |
| C、BF3分子中各原子均达到8e-稳定结构 |
D、甲烷的结构式为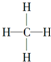 ,它是对称的平面形分子 ,它是对称的平面形分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
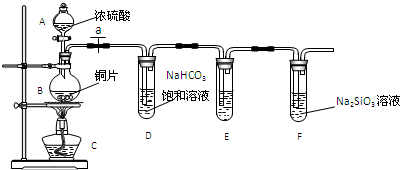
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol H2O中所含的原子总数是0.3NA |
| B、在常温常压下,11.2L氯气所含的原子数为NA |
| C、标准状况下,22.4L氢气所含的质子数为2 2.4NA |
| D、2mol K2SO4中离子的总数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com