
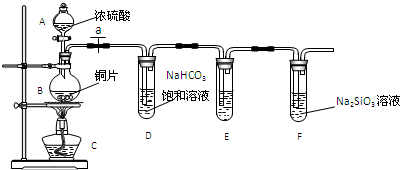
| ||
| ||


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、该温度下此反应的化学平衡常数K=1 |
| B、x=2且B的转化率为25% |
| C、A的平均反应速率为0.6mol?(L?min)-1 |
| D、降低平衡体系的压强,逆反应速率变小,正反应速率增大,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2OH─→CH3CHO |
| B、CH2=CH2─→CH3-CH2Br |
| C、乙酸─→乙酸乙酯 |
| D、氯乙烯─→聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
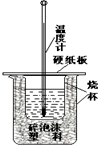 化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛.
化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
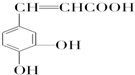
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com