
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为 ,浓度是 mol·L-1。
由②可知存在的离子为 ,浓度是 mol·L-1。
由③可知存在的离子为 ,浓度是 mol·L-1。
(2)该溶液中一定不存在的离子是 (填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
(共10分)(1)NH4+ 0.2;Al3+ 0.2 ; SO42- 0.5 (每空1分,共6分)
(2)Fe3+、Mg2+、Ba2+、CO32-(2分)
(3)已知的NH4+、Al3+的正电荷总量小于SO42-负电荷总量 ,依据电荷守恒,一定有K+存在(2分)
解析试题分析:(1)第一份加过量NaOH溶液后加热,收集到0.02mol气体,这说明生成的气体一定是氨气,物质的量是0.02mol,因此移一定含有NH4+。根据原则守恒可知,浓度NH4+是0.02mol÷0.1L=0.2mol/L。无沉淀生成,同时得到溶液甲,这说明一定没有Fe3+、Mg2+。向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。因此该白色沉淀只能是氢氧化铝,即甲溶液中中含有偏铝酸钠,所以原溶液中含有Al3+,有Al3+,就一定没有CO32-。根据原则守恒可知,Al3+浓度是 =0.2mol/L。第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。这说明该白色沉淀一定是硫酸钡,所以一定含有SO42-,则就一定没有Ba2+。根据原子守恒可知,SO42-的浓度是
=0.2mol/L。第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。这说明该白色沉淀一定是硫酸钡,所以一定含有SO42-,则就一定没有Ba2+。根据原子守恒可知,SO42-的浓度是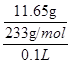 =0.5mol/L。
=0.5mol/L。
(2)该溶液中一定不存在的离子是Fe3+、Mg2+、Ba2+、CO32-。
(3)已知的NH4+、Al3+的正电荷总量小于SO42-负电荷总量,所以依据电荷守恒,一定有K+存在。
考点:考查离子共存、离子的定性检验和定量计算


科目:高中化学 来源: 题型:填空题
.现有失去标签的四瓶无色溶液A.B.C.D,只知道它们是K2CO3.K2SO4.H2SO4和Ba(NO3)2,为了鉴别它们,进行如下实验:
①A+D―→溶液+气体 ②B+C―→溶液+沉淀
③B+D―→溶液+沉淀 ④A+B―→溶液+沉淀
将④得到的沉淀物加入③所得溶液中,④中沉淀很快溶解并产生无色无味的气味。
(1)根据以上实验事实,A.C.D三种无色溶液分别为________、________、________(用化学式表示)。
(2)写出①②中发生反应的离子方程式:
① ;
② 。
(3)离子反应是中学化学中重要的反应类型,在发生离子反应的反应物或生成物中,一定存在有
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程。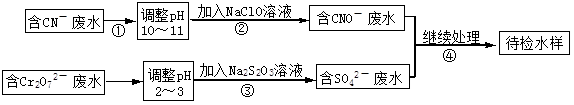 回答以下问题:
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
| A.1 | B.1/2 | C.2 | D.不能确定 |
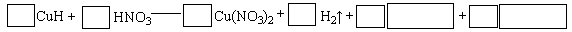
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水是生命之源,水处理工艺在生产生活中占有重要地位。自来水生产的流程示意图如下。(净水剂亦称混凝剂,常用的净水剂有聚合氯化铝、碱式氯化铝、硫酸亚铁、聚丙烯酰胺、聚合氯化铝铁、三氯化铁、聚合硫酸铁等)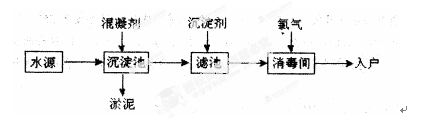
(1)FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)[A12(OH)nClm]是一种无机高分子的高价聚合电解质混凝剂,可视为介于三氯化铝和氢氧化铝之间的一种中间水解产物,则m与n之间的关系 ;
(3)推销净水器的商人用自来水做电解实验,装置如图。一段时间后,两极间产生白色沉淀,并很快变成红褐色,然后用净水器净化后的水做电解实验;两极上只有气体产生,水中并无沉淀,以此来说明自来水很“脏”。则沉淀变成红褐色时所发生的化学反应方程式为: 。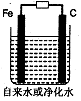
(4)MnSO4是水质检测中的一种常用试剂
①MnSO4和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸盐及另外一种产物,写出并配平上述反应的化学方程式: 。
②水中的溶解氧测定过程为:取水样,迅速加入MnSO4和KOH混合液,再加入KI溶液,立即塞好塞子,振荡使完全反应(反应为:Mn2++O2+H2O→MnOOH,未配平)。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。则该离子反应方程式: 。用Na2S2O3溶液滴定生成的碘,根据消耗溶液的体积可计算出水中溶解氧的量。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、CuCl2中的一种或几种组成,
现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
⑴混合物中是否存在CuCl2 (填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4 (填“是”或“否”),你的判断依据是 。
⑶写出反应③中的离子方程式
。
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)。
___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,
有利于提高SO2的吸收效率。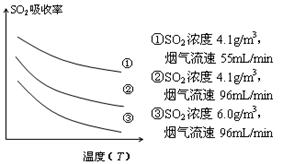
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_ (填字母)。

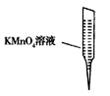
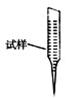
A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用FeC13溶液吸收多余的SO2气体。
(1)写出SO2与FeC13溶液反应的离子方程式: 。
(2)FeC13溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有:H+、Fe2+、C1—、SO42-。某同学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-
假设2:还存在Fe3+
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
| 实验步骤 | 现象和结论 |
| 步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴 溶液。 | 现象: 结论:假设1不成立。 |
| 步骤2: | 现象: 结论:假设2成立。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将1.52 g的铜镁合金完全溶解于50mL14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加人1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.若该浓硝酸的密度为1.40g/mL则该浓硝酸的溶质质量分数为63% |
| B.该合金中铜与镁的物质的最之比是2:1 |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加人NaOH溶液的体积是620 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
卤素间形成的化合物如“IF5、BrCl、IBr”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是( )
| A.IF5 + 3H2O = HIO3 +5HF |
| B.3IBr +2Fe = FeI3 + FeBr3 |
| C.BrCl的氧化性强于I2 |
| D.IBr可以与NaOH溶液反应生成2种盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com