
实验室可用NaNO2+NH4Cl =NaCl+N2↑+2H2O制备N2,下列说法正确的是
| A.NaNO2发生氧化反应 |
| B.NH4Cl中的氮元素被还原 |
| C.N2既是氧化产物,又是还原产物 |
| D.每生成1mol N2转移电子的物质的量为6mol |
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:单选题
某一反应体系中共有Pb3O4、NO、MnO2、Cr2O3、Cr(MnO4)2和Pb(N3)2(名称叠氮化铅,其中Pb为+2价)六种物质,已知Pb(N3)2是反应物之一,Cr2O3是产物之一。请回答下列问题:
(1)已知Cr的常见化合价为+2、+3、+6,Mn的常见化合价为+2、+4、+6、+7,则Cr(MnO4)2中Cr的化合价为 。
(2)1mol Pb(N3)2在反应中 (填“得到”或“失去”) mol电子。
(3)写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击发声的同时产生白色烟雾,反应的化学方程式为:5KC1O3+6P→3P2O5+5KC1。下列有关该反应的叙述中正确的是
| A.P2O5是还原产物 |
| B.发令时产生的白烟一定是KC1固体颗粒 |
| C.可以用白磷代替“火药”中的红磷 |
| D.反应消耗1mol P时转移的电子数为5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
金属铈(稀土元素)性质活泼。铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
| A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+=Ce3+ + Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阳极获得铈 |
D.四种铈的核素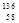 Ce、 Ce、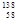 Ce、 Ce、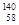 Ce、 Ce、 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3。则下列说法错误的是:( )
| A.反应过程中,被氧化与被还原的元素的物质的量之比为1 :2 |
| B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 |
| D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知R有多种化合价,其最高正价为+7价。在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A.元素R位于周期表中第VA族 |
| B.RO3-中的R只能被还原 |
| C.R-离子的最外层电子数为8 |
| D.若1 mol RO3-参与该反应,则转移的电子的物质的量为5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有______性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+__________。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O +I2===S4O
+I2===S4O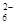 +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示: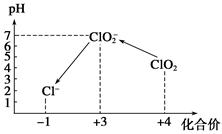
请回答:
①操作Ⅰ中反应的离子方程式是______________________________。
②确定操作Ⅱ完全反应的现象是______________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。含氮元素的化合物在工业生产和国防建设中都有广泛的应用。
(1)氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。PH3分子的空间构型为 ,是 分子。(填极性或非极性)
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)
a.NH3比PH3稳定性强
b.硝酸显强氧化性,磷酸不显强氧化性
c.氮气与氢气能直接化合,磷与氢气很难直接化合
d.氮气常温是气体,磷单质是固体
亚硝酸盐是食品添加剂中急性毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。
(3)亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色变为绿色,反应如下,补上缺项物质并配平:
Cr2O72-+ NO2-+ → Cr3+ + NO3-+
(4)上题反应中每消耗0.6mol NO2-,转移电子数为 。
(5)氮氧化物(NO和NO2)污染环境。若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com