
已知R有多种化合价,其最高正价为+7价。在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A.元素R位于周期表中第VA族 |
| B.RO3-中的R只能被还原 |
| C.R-离子的最外层电子数为8 |
| D.若1 mol RO3-参与该反应,则转移的电子的物质的量为5mol |
CD
解析试题分析:主族元素的最高正价=主族序数,R的最高正价是+7价,则R位于第VIIA族,故A错;由于氧元素显—2价,则RO3-中R的化合价为+5,既能升为+7价,也能降为0价等,因此RO3-中R既能被氧化,又能被还原,故B错;由于原子的最外层电子数=最高正价,则R原子最外层电子数=7,R原子得到1个电子变为R-,则R-中最外层电子数为8,故C正确;R元素由+5价降为0价,化合价降低总数为5,则转移电子数为5,反应:RO3-+5R-+6H+=3R2+3H2O~5e-中转移电子与RO3-的系数之比等于物质的量之比,则1 mol RO3-参与该反应,则转移的电子的物质的量为5mol,故D正确。
考点:考查位、构、性之间的综合推断,涉及主族非金属元素的最高正价、最低负价、中间价态、元素的位置、氧化还原反应、原子核离子的最外层电子数、物质的量在化学方程式中的应用、氧化还原反应中转移电子数的计算等。


科目:高中化学 来源: 题型:单选题
催化反硝化法可治理水中硝酸盐的污染,该方法是用H2将NO3-还原为N2,反应的化学方程式为:5H2+ 2 NO3- xOH-+ N2+4H2O。下列有关说法正确的是
xOH-+ N2+4H2O。下列有关说法正确的是
| A.该反应为置换反应 |
| B.每生成1mol N2,反应转移5mole- |
| C.x=2 |
| D.反应过程中溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2 7N2+8CO+4H2O。
7N2+8CO+4H2O。
下列说法止确的是
| A.C3N3(OH)3与HNCO为同一物质 | B.1mol HNCO与NO2反应时转移3mol电子 |
| C.HNCO是强氧化剂 | D.反应中CO2是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室可用NaNO2+NH4Cl =NaCl+N2↑+2H2O制备N2,下列说法正确的是
| A.NaNO2发生氧化反应 |
| B.NH4Cl中的氮元素被还原 |
| C.N2既是氧化产物,又是还原产物 |
| D.每生成1mol N2转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知Iˉ、Fe2+、SO2、Clˉ、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Clˉ< Fe2+< H2O2< Iˉ< SO2。则下列反应不能发生的是
| A.2Fe3++SO2+2H2O=2Fe2++SO42ˉ+4H+ |
| B.Cl2+SO2+2H2O=H2SO4+2HCl |
| C.H2O2+2H++ SO42ˉ=SO2↑+O2↑+2H2O |
| D.2I2+H2O2=2H2O+O2↑+4 Iˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氨氧化制硝酸的反应如下(未配平):①NH3 + O2 →NO + H2O ②NO + O2 → NO2
③NO2+H2O→HNO3+NO,如将氨全部氧化得2mol硝酸,理论上需氧气的物质的量是( )
| A.2mol | B.3 mol | C.4 mol | D.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1 5分)
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或受热。实验室以电解法制备ClO2的流程如下: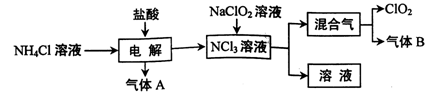
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示方法制得的混合气中杂质气体B能使石蕊试液显蓝色,除去该杂质气体可选用 __;
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是 ;
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产品难以分离,还可能污染环境。写出该方法发生的化学方程式 ;
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是
,此法相比欧洲方法的优点是 。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请将5种物质:N2O、FeCl2、Fe(NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1) + → + + +H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对下列事实的解释正确的是
| A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 |
| B.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
| C.向50mL18mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol |
| D.常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com