
| m |
| M |
| 3.6g |
| 18g/mol |
| 8g |
| 0.3mol |
| 8+28x |
| 0.1+0.2+x |


科目:高中化学 来源: 题型:
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A、溶液中一定不含有CO32-,可能含有SO42-和NO3- |
| B、溶液中的阳离子只有H+、Mg2+、Al3+ |
| C、溶液中n(NH4+)=0.2mol |
| D、n(H+):n(Al3+):n(Mg2+)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验 | 装置或仪器 |
| A | 分离乙酸乙酯中混有的乙酸 |  |
| B | 用已知浓度NaOH滴定未知浓度盐酸 |  |
| C | 从KI和I2的固体混合物中回收I2 |  |
| D | 配制100mL 0.100 0mol?L-1 NaOH溶液 | 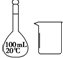 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验方案 | 现象 | 结论 |
| A |  | 向里推活塞时,长颈漏斗中有一段水柱,静止,水柱高度不变 | 该装置的气密性良好 |
| B |  | 脱脂棉燃烧 | Na2O2与水反应生成氢氧化钠和氧气 |
| C |  | 烧杯①的澄清石灰水先变浑浊 | NaHCO3比Na2CO3受热更易分解 |
| D | 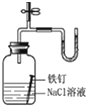 | U形管右端的液面高 | 铁钉发生吸氧腐蚀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| 反应Ⅰ |
| CO(NH2)2 |
| 反应Ⅱ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶质的电离方程式为NaHCO3→Na++H++CO32- |
| B、25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C、离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D、温度升高,c(HCO3-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2 ②NH3?H2O③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② |
| B、将0.1 mol?L-1的NaHS和0.1 mol?L-1Na2S溶液等体积混合:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S) |
| C、将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶解于同一烧杯的水中,制得1 L溶液:c(CH3COO-)+c(OH-)=0.10 mol?L-1 |
| D、已知HClO+Na2CO3=NaClO+NaHCO3,在等物质的量浓度等体积次氯酸溶液与碳酸钠溶液混合溶液中:c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | ||
| B、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | ||
| C、某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、[Al(OH)4]-、SO42- | ||
D、常温下0.1 mol?L-1HA溶液的pH>1,0.1 mol?L-1BOH溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com