
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A、溶液中一定不含有CO32-,可能含有SO42-和NO3- |
| B、溶液中的阳离子只有H+、Mg2+、Al3+ |
| C、溶液中n(NH4+)=0.2mol |
| D、n(H+):n(Al3+):n(Mg2+)=1:1:1 |


科目:高中化学 来源: 题型:
| A、SOCl2是氧化剂,Li是还原剂 |
| B、2 mol SOCl2参加反应,共转移4 mol电子 |
| C、将该反应设计成电池,SOCl2在正极发生反应 |
| D、若将该反应设计成电池,可用稀硫酸作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: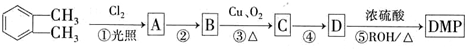
 的名称
的名称 制备DMP的另一种途径:
制备DMP的另一种途径:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀 |
| B、25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂 |
| C、25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强 |
| D、25℃时,NH4++H2O?NH3?H2O+H+的平衡常数为5.6×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NH3在5s内的平均速度为
| ||
| B、达到平衡时NH3的分解率为40% | ||
C、N2的平衡浓度为
| ||
| D、反应开始时与平衡时的压强比为5:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某小组以CoCl2?6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2?6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮氧化合物与碳氢化合物经紫外线照射可发生反应形成有毒烟雾 |
| B、绿色化学的核心是应用化学原理对环境污染进行治理 |
| C、雾霾中含有大量超标的主要物质是二氧化硫 |
| D、食盐中的Na+的焰色反应呈黄色,属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com