
【题目】含有1mol HNO3的稀硝酸分别与不同质量的铁粉,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断正确的是( ) 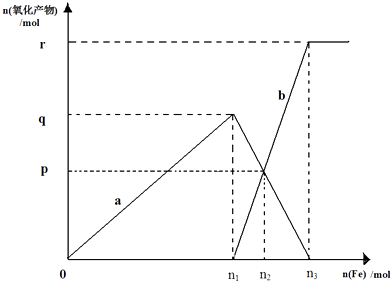
A.a是Fe(NO3)2
B.n1=0.375
C.p=0.20
D.n2=0.30
【答案】D
【解析】解:向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3 , 反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为1mol利用方程式可计算出生成的 Fe(NO3)3为0.25mol,所以参加反应的铁为0.25mol即n1=0.25,a为 Fe(NO3)3 , 故AB错误;
C.Fe(NO3)3 与过量的铁继续反应生成 Fe(NO3)2 , 反应方程式为:2Fe(NO3)3+Fe=3 Fe(NO3)2 , P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,设生成的 Fe(NO3)2物质的量xmol,则利用方程式可求得x=0.15,即P=0.15,故C错误;
D.再根据铁原子守恒,n(Fe)=n(Fe((NO3)2)+n (Fe(NO3)),所以 n(Fe)=0.3mol即n2=0.3mol,故D正确.
故选D.
向稀硝酸中加入铁粉时,开始先生成Fe(NO3)3 , 当铁过量时,过量的铁再与 Fe(NO3)3反应生成 Fe(NO3)2 , 反应涉及两个方程式.


科目:高中化学 来源: 题型:
【题目】有A、B、C、D 4种短周期元素,它们的元素原子序数依次增大,由B、C、D形成的离子具有相同的电子层结构.B原子的最外层电子数是次外层的三倍,C、D单质都能跟水剧烈反应,1mol D单质跟水反应产生11.2L(标准状况)A气体,此时D转化为具有氖原子核外电子层结构的离子.试填写:
(1)用电子式表示A和C形成化合物的过程 .
(2)C原子的结构示意图 , 写出A、B两元素按1:1原子个数比形成化合物的电子式 .
(3)这4种元素的原子半径由大到小的顺序为 . (用元素符号表示)
(4)写出C单质与水反应的化学反应方程式;.
(5)写出D单质与水反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60mL
B.45mL
C.30mL
D.15mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O, 则下列说法正确的是( )
2PbSO4+2H2O, 则下列说法正确的是( )
A. 放电时:当外电路通过1mol的电子时,理论上负极板的质量增加了151.5g
B. 充电时:阳极反应是PbSO4-2e-+2H2O = PbO2+SO42-+4H+
C. 放电时:正极反应是Pb-2e-+SO42-= PbSO4
D. 充电时:铅蓄电池的阴极应与电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学用下列装置制备并检验Cl2的性质

下列说法正确的是
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完
B.Ⅱ图中:生成蓝色的烟
C.Ⅲ图中:量筒中发生了加成反应
D.Ⅳ图中:湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确定某种矿质元素是否是植物的必需元素,应采用的方法是
A. 检测正常叶片中该矿质元素的含量
B. 分析根系对该矿质元素的吸收过程
C. 分析环境条件对该植物吸收矿质元素的影响
D. 观察在完全培养液中去掉该矿质元素前后植株的生长发育状况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com