
【题目】指定条件的同分异构体。
(1)分子式为C3H6O,不能使溴的CCl4褪色,其核磁共振氢谱为单峰,其结构简式为:_____。
(2)分子式为C4H9Cl的物质,核磁共振氢谱表明其只有一种化学环境的氢;其结构简式为_____。
(3)某烃的含氧衍生物的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰。其结构简式为____。
(4)分子式为C7H5O2Cl的同分异构体中含有苯环且能发生银镜反应的共有_____种,[不考虑-OCl这种基团]其中核磁共振氢谱显示有三种不同化学环境的氢,且峰面积比为2:2:1的是____(写结构简式)。
【答案】CH3COCH3 (CH3)3CCl CH3COCH3 13 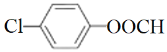
【解析】
(1)分子式为C3H6O,不能使溴的CCl4褪色,其核磁共振氢谱为单峰,说明6个氢是一种位置的氢,两个甲基,中间为羰基,其结构简式为:CH3COCH3。
(2)分子式为C4H9Cl的物质,核磁共振氢谱表明其只有一种化学环境的氢;说明9个氢原子是一种环境的氢,有3个甲基,其结构简式为(CH3)3CCl;故答案为:(CH3)3CCl。
(3)某烃的含氧衍生物的相对分子量为58,氧元素质量分数为0.276,则氧原子个数为N(O)= ![]() ,剩余碳氢分子量为58-16 =42,42÷12 =36,即分子式为C3H6O,核磁共振氢谱显示为单峰,说明6个氢是一种位置的氢,两个甲基,中间为羰基,其结构简式为:CH3COCH3。
,剩余碳氢分子量为58-16 =42,42÷12 =36,即分子式为C3H6O,核磁共振氢谱显示为单峰,说明6个氢是一种位置的氢,两个甲基,中间为羰基,其结构简式为:CH3COCH3。
(4)分子式为C7H5O2Cl的同分异构体中含有苯环且能发生银镜反应,说明含有-CHO、-OH、-Cl或含有-OOCH、-Cl,当含有-CHO、-OH、-Cl时,-CHO、-OH有邻、间、对三种位置,则相应-Cl位置分别有4种、4种、2种同分异构体,当含有-OOCH、-Cl时,有邻、间、对3种同分异构体,因此共有13种[不考虑—OCl这种基团],其中核磁共振氢谱显示有三种不同化学环境的氢,且峰面积比为2:2:1的是 ;故答案为:13;
;故答案为:13; 。
。


科目:高中化学 来源: 题型:
【题目】硼(B)、铝及其化合物在化学中有重要的地位。请回答下列问题:
Ⅰ.(1)与B的基态原子电子排布式中成单电子数相同的第二周期元素还有______(填写元素符号)。
Ⅱ.硼酸(H3BO3)是白色片状晶体(层状结构如图1),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
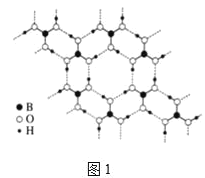
(2)硼酸分子以范德华力、共价键和氢键形成环状结构,每个含有B原子的环中平均含有B原子的个数为______个。其中B原子的杂化类型为______。
(3)加热时,硼酸的溶解度增大,主要原因是______。
(4)硼酸是一元弱酸,其分子式亦可写为B(OH)3,在水中电离时,硼酸结合水电离出来OH-的而呈酸性,写出硼酸的电离方程式______。
(5)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子的结构式或结构简式为______
(标出配位键)。
Ⅲ.硼氢化钠是一种常用的还原剂。其晶胞结构如图2所示:
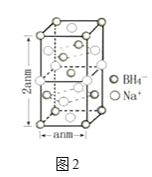
(6)该晶体中Na+的配位数为______。
(7)若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为______。
(8)LiAlH4也是一种特殊的还原剂,可将羧酸直接还原成醇:CH3COOH![]() CH3CH2OH,CH3COOH分子中键角2______键角1(填“>”、“<”或“=”)。
CH3CH2OH,CH3COOH分子中键角2______键角1(填“>”、“<”或“=”)。
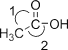
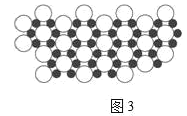
Ⅳ.(9)硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,如图3是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,某小组在实验室中制备ClO2所用装置如图:[已知:SO2+2NaClO3+H2SO4=2ClO2+2NaHSO4]。
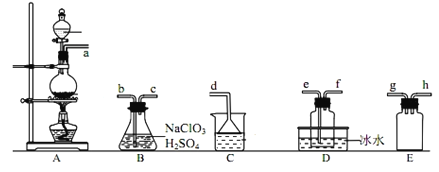
下列说法正确的是( )
A.装置C中装的是饱和食盐水,a流出气体为SO2
B.装置D放冰水的目的是液化二氧化硫防止污染环境
C.连接装置时,导管口a可接h或g,导管口c接e
D.可以选用装置A利用3mo/L盐酸与MnO2反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。回答下列问题:
(1)2016年![]() 确认了四种新元素,其中一种为
确认了四种新元素,其中一种为![]() ,中文名为“
,中文名为“![]() ”。元素
”。元素![]() 可由反应:
可由反应:![]() +
+![]() =
=![]() +3
+3![]() 得到。该元素的质子数为______,
得到。该元素的质子数为______,![]() 与
与![]() 互为_________。
互为_________。
(2)![]() 位于元素周期表中第
位于元素周期表中第![]() 族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式________________.该分子内存在的共价键类型有_______。
族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式________________.该分子内存在的共价键类型有_______。
(3)该族中的另一元素P能呈现多种化合价,其中![]() 价氧化物的分子式为______,
价氧化物的分子式为______,![]() 价简单含氧酸的分子式为______。
价简单含氧酸的分子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 molL﹣1s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Cu、Cr都是第四周期过渡元素,回答下列问题。
(1)FeCl3是一种常用的净水剂,Cl元素的原子核外有___种不同运动状态的电子;有___种不同能级的电子,基态Fe3+的电子排布式为___。
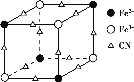
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是___;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的![]() 结构如图所示(K+未画出),则一个晶胞中的K+个数为___。
结构如图所示(K+未画出),则一个晶胞中的K+个数为___。
(3)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:![]() ,该配离子中含有的化学键类型有___(填字母)。
,该配离子中含有的化学键类型有___(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有___个σ键,C原子的杂化方式为___。
(4)金属铜的晶胞为面心立方最密堆积,边长为361pm。则铜原子的直径约为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,48gO3含有的氧原子数为3NA
B.1.8g的NH4+离子中含有的电子数为0.1NA
C.常温常压下,11.2 L氧气所含的原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锆(ZrO2)材料具有高硬度、高熔点、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
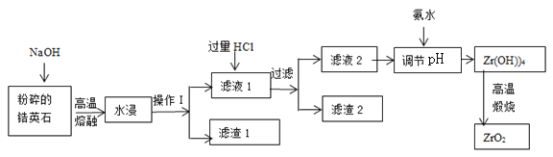
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有________________________________。
(2)操作I的名称是__________________,滤渣1成分为_________,滤渣2的成分为_____________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:____________________。
(4)“调节pH”时,合适的pH范围是__________________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是__________________。
(5)写出“高温煅烧”过程的化学方程式________________________________。根据ZrO2的性质,推测其一种用途________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com