
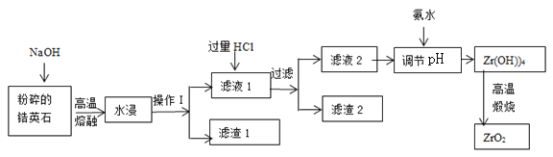
【题目】氧化锆(ZrO2)材料具有高硬度、高熔点、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有________________________________。
(2)操作I的名称是__________________,滤渣1成分为_________,滤渣2的成分为_____________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:____________________。
(4)“调节pH”时,合适的pH范围是__________________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是__________________。
(5)写出“高温煅烧”过程的化学方程式________________________________。根据ZrO2的性质,推测其一种用途________________________________。
【答案】粉碎、高温 过滤 Fe2O3 H2SiO3 4NaOH+ZrSiO4![]() Na2ZrO3+Na2SiO3+2H2O 3.2~3.4 取最后一次洗涤液加入硝酸银溶液和稀硝酸,没有白色沉淀证明洗涤干净 Zr(OH)4
Na2ZrO3+Na2SiO3+2H2O 3.2~3.4 取最后一次洗涤液加入硝酸银溶液和稀硝酸,没有白色沉淀证明洗涤干净 Zr(OH)4![]() ZrO2+2H2O 耐火材料、坩埚、打磨材料牙齿材料等
ZrO2+2H2O 耐火材料、坩埚、打磨材料牙齿材料等
【解析】
锆英砂(主要成分为ZrSiO4,还含少量Fe2O3、Al2O3、SiO2等杂质)加NaOH熔融,二氧化硅反应转化为硅酸钠,ZrSiO4转化为Na2SiO3和Na2ZrO3,氧化铝和氢氧化钠反应生成偏铝酸钠,水浸过滤,滤渣1为Fe2O3,得到滤液1中加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,偏铝酸钠和过量盐酸反应得到氯化铝,滤渣2为H2SiO3,滤液中含有ZrO2+、Al3+,加氨水调节pH为3.2~3.4使ZrO2+转化为Zr(OH)4沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2。
(1)流程中旨在提高化学反应速率的措施有粉碎固体,升高温度。
(2)操作Ⅰ用于分离固体和液体,操作I的名称是过滤,滤渣1成分为Fe2O3,滤渣2的成分为H2SiO3。
(3)锆英石经“高温熔融”转化为Na2ZrO3,高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3,该反应的化学方程式:4NaOH+ZrSiO4![]() Na2ZrO3+Na2SiO3+2H2O。
Na2ZrO3+Na2SiO3+2H2O。
(4)“调节pH”时,合适的pH范围是3.2~3.4使ZrO2+完全转化为Zr(OH)4沉淀,且避免生成Al(OH)3;Zr(OH)4表面为附着Cl-等,为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净。
(5)“高温煅烧”过程的化学方程式Zr(OH)4![]() ZrO2+2H2O。根据ZrO2的性质,推测其一种用途,推测其两种用途有耐火材料、磨料等。
ZrO2+2H2O。根据ZrO2的性质,推测其一种用途,推测其两种用途有耐火材料、磨料等。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】指定条件的同分异构体。
(1)分子式为C3H6O,不能使溴的CCl4褪色,其核磁共振氢谱为单峰,其结构简式为:_____。
(2)分子式为C4H9Cl的物质,核磁共振氢谱表明其只有一种化学环境的氢;其结构简式为_____。
(3)某烃的含氧衍生物的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰。其结构简式为____。
(4)分子式为C7H5O2Cl的同分异构体中含有苯环且能发生银镜反应的共有_____种,[不考虑-OCl这种基团]其中核磁共振氢谱显示有三种不同化学环境的氢,且峰面积比为2:2:1的是____(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中关于离子共存的说法正确的是( )
A.25℃时溶液中一定大量共存:Na+、Ca2+、Cl-、![]()
B.能与铝反应放出氢气的溶液中一定共存:Mg2+、Cu2+、![]() 、
、![]()
C.弱碱性溶液中可能大量共存:Na+、K+、Cl、![]()
D.0.1mol/LFeCl3溶液中可能大量共存:Fe2+、![]() 、SCN-、
、SCN-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾、高铬酸是一种典型的强氧化剂。完成下列填空:
(1)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2 已知该反应中H2O2只发生如下过程:H2O2→O2
①该反应中的还原剂是_____________。
②该反应中,发生还原反应的过程是____________→__________。
③写出该反应的化学方程式_______________________。
(2)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO4-+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
下列关于反应①的说法中正确的是______________(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,反应转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(3)在稀硫酸中,![]() 和H2O2也能发生氧化还原反应。
和H2O2也能发生氧化还原反应。
已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被2 mol KMnO4氧化的H2O2是____________mol。
(4)高锰酸钾溶液与硫化亚铁固体有如下反应:
10FeS+6KMnO4+24H2SO4===3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,常用作食品添加剂,使用时必须严格控制其用量。某化学科研小组同学拟在实验室中利用下列流程和实验装置制备亚硝酸钠:
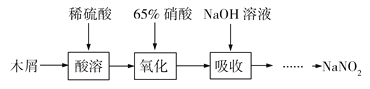
已知:①木屑的水解:(C6H10O5)n(纤维素)+nH2O![]() nC6H12O6(葡萄糖)
nC6H12O6(葡萄糖)
②氧化过程中控制反应温度在35~60 ℃,主要发生反应:C6H12O6+12HNO33HOOC—COOH+9NO2↑+3NO↑+9H2O
③NaOH溶液吸收NO和NO2发生反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O
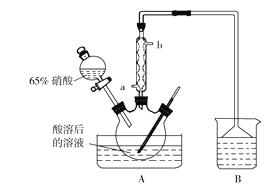
请完成下列问题:
(1)木屑的主要成分是纤维素,结合信息①,检验纤维素已水解所需的化学试剂为______________。
(2)氧化过程中控制温度在35~60 ℃的原因是________________________;A装置中冷凝管应该从_________(填“a”或“b”)口进冷却水。
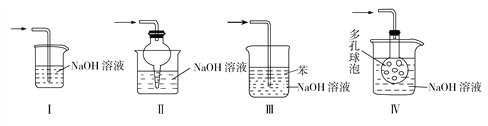
(3)使用B装置吸收气体的目的是__________________;下列装置可以代替B装置的是______(填装置编号)。
(4)实验过程中在A装置的三颈烧瓶中观察到的现象是______________________。
(5)测定产品纯度:
a.准确称量a g产品配制100.00 mL溶液;
b.移取20.00 mL所配溶液置于锥形瓶中;
c.用c mol·L1的酸性KMnO4溶液滴定至终点;
d.重复实验3次,消耗酸性KMnO4溶液的平均体积为V mL。
①滴定过程中反应的离子方程式为__________________________;盛放酸性KMnO4溶液应选用_______滴定管(填“酸式”或“碱式”);若在滴定操作中发现溶液呈紫红色立即记下所消耗KMnO4溶液的体积,但很快发现溶液又变成无色,则测量结果______(填“偏大”“偏小”或“无影响”。)
②产品中NaNO2的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框中的字母表示一种反应物或生成物(部分物质,反应条件已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
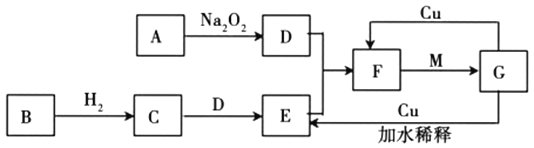
(1)写出![]() 的化学方程式:_______________________。
的化学方程式:_______________________。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为_________,干燥C常用_______________(填写试剂名称)。
(3)E物质遇到D物质时,会观察到_______________________现象,若用排水法收集F,则最终集气瓶中收集到的气体为____________________(写化学式)。
(4)写出![]() 的离子反应方程式_________________________。
的离子反应方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质(均为中学化学常见物质)转化关系图中,D为红棕色粉末(反应条件及部分反应物、产物未全部说明),B、C、E为常见单质,A、D为氧化物。
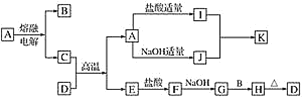
根据图示转化关系填写下列空白:
(1)写出下列物质的化学式A________,B________,G________。
(2)C与D的混合物通常称__________(填名称)。
(3)写出下列化学方程式或离子方程式
①I+J→K________________(离子方程式)。
②G+B→H________________(化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于古籍中的记载说法不正确的是
A. 《本草纲目》“烧酒”条目下写道自元时始创其法,用浓酒和糟入甑,蒸令气上其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
B. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚” 体现了合金硬度方面的特性
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
D. 《抱朴子·金丹篇》中记载:“丹砂(HgS)烧之成水银,积变又成丹砂”,该过程发生了分解、化合、氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com