
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,常用作食品添加剂,使用时必须严格控制其用量。某化学科研小组同学拟在实验室中利用下列流程和实验装置制备亚硝酸钠:
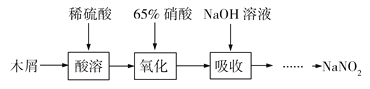
已知:①木屑的水解:(C6H10O5)n(纤维素)+nH2O![]() nC6H12O6(葡萄糖)
nC6H12O6(葡萄糖)
②氧化过程中控制反应温度在35~60 ℃,主要发生反应:C6H12O6+12HNO33HOOC—COOH+9NO2↑+3NO↑+9H2O
③NaOH溶液吸收NO和NO2发生反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O
请完成下列问题:
(1)木屑的主要成分是纤维素,结合信息①,检验纤维素已水解所需的化学试剂为______________。
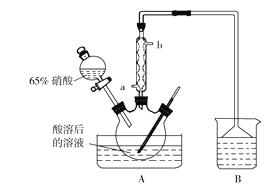
(2)氧化过程中控制温度在35~60 ℃的原因是________________________;A装置中冷凝管应该从_________(填“a”或“b”)口进冷却水。
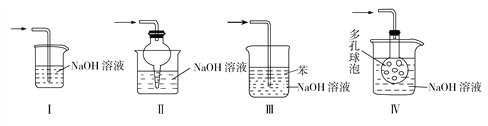
(3)使用B装置吸收气体的目的是__________________;下列装置可以代替B装置的是______(填装置编号)。
(4)实验过程中在A装置的三颈烧瓶中观察到的现象是______________________。
(5)测定产品纯度:
a.准确称量a g产品配制100.00 mL溶液;
b.移取20.00 mL所配溶液置于锥形瓶中;
c.用c mol·L1的酸性KMnO4溶液滴定至终点;
d.重复实验3次,消耗酸性KMnO4溶液的平均体积为V mL。
①滴定过程中反应的离子方程式为__________________________;盛放酸性KMnO4溶液应选用_______滴定管(填“酸式”或“碱式”);若在滴定操作中发现溶液呈紫红色立即记下所消耗KMnO4溶液的体积,但很快发现溶液又变成无色,则测量结果______(填“偏大”“偏小”或“无影响”。)
②产品中NaNO2的纯度为____________。
【答案】NaOH溶液、新制Cu(OH)2(或NaOH溶液、银氨溶液) 防止硝酸受热分解 a 防止倒吸 Ⅱ、Ⅳ 溶液中有气泡冒出,在液面上方变成红棕色 5![]() +2
+2![]() +6H+2Mn2++5
+6H+2Mn2++5![]() +3H2O 酸式 偏小
+3H2O 酸式 偏小 ![]() (或
(或![]() %)
%)
【解析】
木屑的主要成分是纤维素[(C6H10O5)n],酸溶后得葡萄糖溶液,用葡萄糖还原硝酸得NO和NO2,用NaOH吸收NO和NO2,得到NaNO2;HNO3不稳定,温度过高发生分解,所以反应温度不宜高于60℃,NaOH溶液呈碱性,
(1)酸溶过程中,硫酸的作用是催化剂;检验水解产物需要碱性环境;
(2)硝酸易分解;结合冷凝管的冷凝作用分析;
(3)NaOH溶液呈碱性,结合防止倒吸的操作分析;
(4)二氧化氮为红棕色,结合实验过程与现象分析;
(5)测定产品纯度,利用KMnO4氧化NO2-进行滴定计算NaNO2的含量,反应过程中高锰酸钾溶液的紫色会褪色,当达到滴定终点时,高锰酸钾溶液的紫色就不会褪色,根据电子得失守恒可得关系式2KMnO4~5NaNO2,根据KMnO4的物质的量,可求得NaNO2的质量,进而确定产品中NaNO2的纯度。
(1)在纤维素的水解过程中硫酸做催化剂,要检验水解生成的葡萄糖,需先加NaOH溶液中和至碱性,再加入新制Cu(OH)2或银氨溶液。
(2)在用65%硝酸做氧化剂时,控温35~60 ℃的目的是防止硝酸的分解;冷凝管中冷却水应该遵循逆流原理,必须从下口,即a口进入冷却水。
(3)用倒扣漏斗吸收NO2和NO,是为了防止倒吸。装置Ⅰ不能防止倒吸;装置Ⅱ可以防止倒吸;装置Ⅲ中导管口通入NaOH溶液中,不能防止倒吸,应将苯换成CCl4,CCl4在下层,NaOH溶液在上层;装置Ⅳ可以防止倒吸,故Ⅱ和Ⅳ可代替B装置。
(4)在浓硝酸氧化葡萄糖的过程中有NO2和NO放出,因而可在溶液中看到有气泡冒出,在液面上方观察到红棕色。
(5)①用酸性KMnO4溶液滴定NaNO2发生氧化还原反应,根据得失电子相等和原子守恒可得离子方程式:5![]() +2
+2![]() +6H+2Mn2++5
+6H+2Mn2++5![]() +3H2O。酸性KMnO4溶液具有强氧化性,应盛放在酸式滴定管中;在未到达终点时,滴入紫红色KMnO4溶液立即褪色,若观察溶液呈紫红色,一会又褪色,说明酸性KMnO4滴加量不足,造成计算结果偏小。
+3H2O。酸性KMnO4溶液具有强氧化性,应盛放在酸式滴定管中;在未到达终点时,滴入紫红色KMnO4溶液立即褪色,若观察溶液呈紫红色,一会又褪色,说明酸性KMnO4滴加量不足,造成计算结果偏小。
②根据反应离子方程式得:n(![]() )=
)=![]() n(
n(![]() )=
)=![]() ×cV×103mol,则m(NaNO2)=69 g·mol1×
×cV×103mol,则m(NaNO2)=69 g·mol1×
![]() mol=
mol=![]() g,故样品的纯度ω(NaNO2)=5×
g,故样品的纯度ω(NaNO2)=5×![]() g÷a g×100%=
g÷a g×100%=![]() ×
×
100%=![]() %。
%。


科目:高中化学 来源: 题型:
【题目】自门捷列夫发现元素周期律以来,人类对自然的认识程度逐步加深,元素周期表中的成员数目不断增加。回答下列问题:
(1)2016年![]() 确认了四种新元素,其中一种为
确认了四种新元素,其中一种为![]() ,中文名为“
,中文名为“![]() ”。元素
”。元素![]() 可由反应:
可由反应:![]() +
+![]() =
=![]() +3
+3![]() 得到。该元素的质子数为______,
得到。该元素的质子数为______,![]() 与
与![]() 互为_________。
互为_________。
(2)![]() 位于元素周期表中第
位于元素周期表中第![]() 族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式________________.该分子内存在的共价键类型有_______。
族,同族元素N的一种氢化物为NH2NH2,写出该化合物分子的电子式________________.该分子内存在的共价键类型有_______。
(3)该族中的另一元素P能呈现多种化合价,其中![]() 价氧化物的分子式为______,
价氧化物的分子式为______,![]() 价简单含氧酸的分子式为______。
价简单含氧酸的分子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是
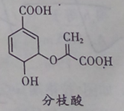
A.分子中含有2种官能团
B.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可与乙醇、乙酸反应,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C. 阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土资源素有“工业维生素”“新材料之母”之称,我国稀土储量世界第一。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应(注:铈常见的化合价为![]() 和
和![]() ,氧化性:
,氧化性:![]() )。下列说法正确的是( )
)。下列说法正确的是( )
A.铈溶于氢碘酸的化学方程式可表示为:![]()
B.![]() 溶液与硫酸铁溶液混合,其离子方程式为:
溶液与硫酸铁溶液混合,其离子方程式为:![]()
C.铈元素如果要排在金属活动性顺序表中,其位置应靠近![]() 元素
元素
D.金属![]() 保存时可以用水封来隔绝空气,防止被氧化
保存时可以用水封来隔绝空气,防止被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锆(ZrO2)材料具有高硬度、高熔点、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
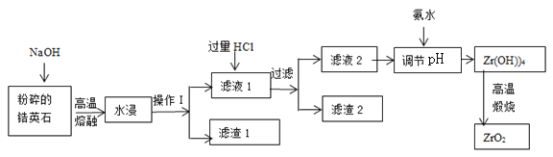
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有________________________________。
(2)操作I的名称是__________________,滤渣1成分为_________,滤渣2的成分为_____________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:____________________。
(4)“调节pH”时,合适的pH范围是__________________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是__________________。
(5)写出“高温煅烧”过程的化学方程式________________________________。根据ZrO2的性质,推测其一种用途________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某大型化工厂产生的酸性废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
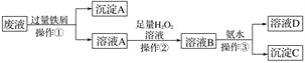
(1)操作①的名称是________________, 沉淀A中含有的金属单质有________________。
(2)溶液A中加入H2O2溶液过程中发生反应的离子反应式________________________________,操作②为持续加热保温,在此过程中温度不宜过高的原因是________________________________。
(3)检验溶液B中含有的金属阳离子的实验方法为:取少量溶液B于洁净的小试管中,加入______试剂,溶液迅速转变为________色,即可检验。
(4)操作③中发生反应的离子方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___离子,滤渣中含有___;在溶解过滤时使用的仪器有___。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____。
(5)计算该样品中铝的质量分数的表达式为___。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___(“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各对物质,互为同系物的是( )
A.CH3—CH=CH2与![]()
B.![]() 与
与![]()
C.CH3COOCH3与CH3CH2COOCH3
D.CH3CH2Cl与CH3CHCl—CH2Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com