
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是
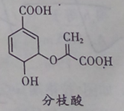
A.分子中含有2种官能团
B.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可与乙醇、乙酸反应,且反应类型相同
 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为如图所示的烃,下列说法中正确的是( )
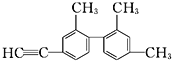
A. 分子中处于同一直线上的碳原子最多有6个
B. 该烃苯环上的二氯代物共有13种
C. 该烃的一氯代物共有8种
D. 分子中至少有12个碳原子处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铅铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠 (Na2Cr2O72H2O),其主要反应为:
①4FeO Cr2O3 + 8Na2CO3 + 7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4 + H2SO4 ![]() Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
下列说法中正确的是
A.反应①和②均为氧化还原反应
B.反应①中FeO Cr2O3是还原剂,在反应中失去电子。
C.反应②中Na2CrO4发生氧化反应
D.生成l mol的CO2,反应①转移3.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由CuO和KHC2O4溶液反应的到的蓝色结晶[KaCub(C2O4)cdH2O]。为测定其组成,进行了如下实验:
步骤1称取3.5400 g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100 mL溶液A.
步骤2量取20.00 mLA溶液,滴加0.2000 mol L-1 KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00 mL。
步骤3另取20.00 mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16 g。
己知:步骤2 中发生反应:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2↑ + 8H2O。
(1)步骤1中配制溶液A时,需要用到的玻璃仪器有烧杯、玻璃棒、_____。
(2)3.5400 g 该样品中含 n(C2O42-)= ____mol。
(3)3.5400 g 该样品中含 n(Cu2+)= ____mol。
(4)通过计算确定该蓝色晶体的化学式__________(计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填表
微粒 | 核外电子数 | 中子数 | 质量数 | 最外层电子数 |
| __________ | ____________ | _________ | _________ |
| _________ | ___________ | _________ | ____________ |
| ___________ | ________ | ______ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中关于离子共存的说法正确的是( )
A.25℃时溶液中一定大量共存:Na+、Ca2+、Cl-、![]()
B.能与铝反应放出氢气的溶液中一定共存:Mg2+、Cu2+、![]() 、
、![]()
C.弱碱性溶液中可能大量共存:Na+、K+、Cl、![]()
D.0.1mol/LFeCl3溶液中可能大量共存:Fe2+、![]() 、SCN-、
、SCN-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化还原反应,下列说法正确的是( )
①Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子 ,因此还原性Al>Mg;
②氧化剂具有氧化性;
③有单质参加的反应一定是氧化还原反应;
④2Fe+3Cl2![]() 2FeCl3;Fe+S
2FeCl3;Fe+S![]() FeS,由此可以判断氧化性:Cl2>S
FeS,由此可以判断氧化性:Cl2>S
⑤氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
A.②③④ B.②④ C.①②⑤ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,常用作食品添加剂,使用时必须严格控制其用量。某化学科研小组同学拟在实验室中利用下列流程和实验装置制备亚硝酸钠:
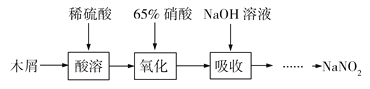
已知:①木屑的水解:(C6H10O5)n(纤维素)+nH2O![]() nC6H12O6(葡萄糖)
nC6H12O6(葡萄糖)
②氧化过程中控制反应温度在35~60 ℃,主要发生反应:C6H12O6+12HNO33HOOC—COOH+9NO2↑+3NO↑+9H2O
③NaOH溶液吸收NO和NO2发生反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O
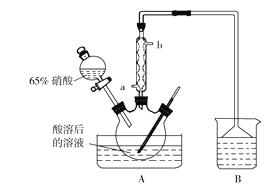
请完成下列问题:
(1)木屑的主要成分是纤维素,结合信息①,检验纤维素已水解所需的化学试剂为______________。
(2)氧化过程中控制温度在35~60 ℃的原因是________________________;A装置中冷凝管应该从_________(填“a”或“b”)口进冷却水。
(3)使用B装置吸收气体的目的是__________________;下列装置可以代替B装置的是______(填装置编号)。
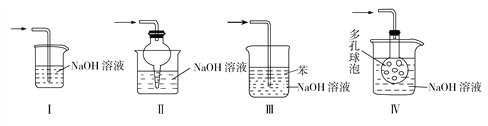
(4)实验过程中在A装置的三颈烧瓶中观察到的现象是______________________。
(5)测定产品纯度:
a.准确称量a g产品配制100.00 mL溶液;
b.移取20.00 mL所配溶液置于锥形瓶中;
c.用c mol·L1的酸性KMnO4溶液滴定至终点;
d.重复实验3次,消耗酸性KMnO4溶液的平均体积为V mL。
①滴定过程中反应的离子方程式为__________________________;盛放酸性KMnO4溶液应选用_______滴定管(填“酸式”或“碱式”);若在滴定操作中发现溶液呈紫红色立即记下所消耗KMnO4溶液的体积,但很快发现溶液又变成无色,则测量结果______(填“偏大”“偏小”或“无影响”。)
②产品中NaNO2的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.同温、同压下,相同质量的气体都占有相同的体积
B.同温、同压下,相同体积的气体都含有相同数目的分子
C.气体摩尔体积约为22.4 L/mol,一定是在标准状况下
D.18 g H2O在标准状况下的体积约为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com