
【题目】Fe、Cu、Cr都是第四周期过渡元素,回答下列问题。
(1)FeCl3是一种常用的净水剂,Cl元素的原子核外有___种不同运动状态的电子;有___种不同能级的电子,基态Fe3+的电子排布式为___。
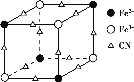
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是___;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的![]() 结构如图所示(K+未画出),则一个晶胞中的K+个数为___。
结构如图所示(K+未画出),则一个晶胞中的K+个数为___。
(3)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:![]() ,该配离子中含有的化学键类型有___(填字母)。
,该配离子中含有的化学键类型有___(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有___个σ键,C原子的杂化方式为___。
(4)金属铜的晶胞为面心立方最密堆积,边长为361pm。则铜原子的直径约为___pm。
【答案】17 5 1s22s22p63s23p63d5 K2[Fe(SCN)5] 4 abd 11 sp3 ![]()
【解析】
⑴每个电子的运动状态均不同,氯原子核外电子分布在1s、2s、2p、3s、3p这五个能级;铁原子失去4s能级2个电子,再失去3d能级1个电子形成Fe3+。
⑵Fe3+与SCN-形成配位数为5的配离子为[Fe(SCN)5]2-,根据电荷守恒可知配离子与K+形成的配合物的化学式为K2[Fe(SCN)5];计算晶胞中其他微粒的个数,再根据电荷守恒计算钾离子的个数。
⑶根据配合物的结构可以知道含有的化合建,并计算σ数,求出杂化方式。
⑷面心立方最密堆积的晶胞结构中,处于面对角线上的Cu原子紧密相邻,面对角线的长度为铜原子直径的2倍。
⑴氯原子核外电子数为17,每个电子的运动状态均不同,故氯原子核外有17种不同运动状态的电子;氯原子核外电子排布式为1s22s22p63s23p5,电子分布在1s、2s、2p、3s、3p这五个能级;Fe是26号元素,铁原子核外电子排布式为1s22s22p63s23p63d64s2,铁原子失去4s能级2个电子,再失去3d能级1个电子形成Fe3+,故基态Fe3+的电子排布式为1s22s22p63s23p63d5;故答案为:17;5;1s22s22p63s23p63d5。
⑵Fe3+与SCN-形成配位数为5的配离子为[Fe(SCN)5]2-,根据电荷守恒可知配离子与K+形成的配合物的化学式为K2[Fe(SCN)5];题给物质晶胞的![]() 结构中,Fe3+的个数为4×
结构中,Fe3+的个数为4×![]() =
=![]() ,Fe2+的个数为4×
,Fe2+的个数为4×![]() =
=![]() ,CN-的个数为12×
,CN-的个数为12×![]() =3,根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2 = N(CN-),可得N(K+)=
=3,根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2 = N(CN-),可得N(K+)=![]() ,故一个晶胞中的K+个数为
,故一个晶胞中的K+个数为![]() ×8=4,故答案为:K2[Fe(SCN)5];4。
×8=4,故答案为:K2[Fe(SCN)5];4。
⑶Cu2+与乙二胺(H2N—CH2—CH2—NH2)之间形成配位键,H2N—CH2—CH2—NH2中碳原子之间形成非极性键,不同原子之间形成极性键;单键为σ键,一个乙二胺分子中含有11个σ键,碳原子没有孤电子对,且形成4个σ键,杂化轨道数目为4,碳原子采取sp3杂化,故答案为:abd;11;sp3。
⑷面心立方最密堆积的晶胞结构中,处于面对角线上的Cu原子紧密相邻,面对角线的长度为铜原子直径的2倍,由几何知识可知面对角线长度等于晶胞边长的![]() 倍,故铜原子的直径约为=
倍,故铜原子的直径约为=![]() =
=![]() pm,故答案为
pm,故答案为![]() pm。
pm。


科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是-种难溶的物质,可用CuSO4溶液和“另一种物质”在40C~50C时反应来制备,CuH不稳定,它既能与HCl反应产生气体,又能在氯气中燃烧,以下有关判断不正确的是 ( )
A. CuH既可做氧化剂又可做还原剂
B. 另一种物质一定具有还原性
C. CuH跟HCl反应的化学方程式为:2CuH+2HCl=CuCl2+2H2↑+Cu
D. CuH在Cl2燃烧的化学方程式为:CuH+Cl2 ![]() CuCl+HCl
CuCl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如下图所示:

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是________;b的名称是________;
(2)a中发生主要反应的化学方程式为____________________________;本实验最容易产生的有机副产物的结构简式为________。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加人无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
(3)用碳酸钠溶液洗涤的作用是________,操作X的名称为________。
Ⅲ.产物分析及产率计算
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有_______种不同化学环境的氢原子。
② 本实验所得环己烯的产率是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】指定条件的同分异构体。
(1)分子式为C3H6O,不能使溴的CCl4褪色,其核磁共振氢谱为单峰,其结构简式为:_____。
(2)分子式为C4H9Cl的物质,核磁共振氢谱表明其只有一种化学环境的氢;其结构简式为_____。
(3)某烃的含氧衍生物的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰。其结构简式为____。
(4)分子式为C7H5O2Cl的同分异构体中含有苯环且能发生银镜反应的共有_____种,[不考虑-OCl这种基团]其中核磁共振氢谱显示有三种不同化学环境的氢,且峰面积比为2:2:1的是____(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铅铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠 (Na2Cr2O72H2O),其主要反应为:
①4FeO Cr2O3 + 8Na2CO3 + 7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4 + H2SO4 ![]() Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
下列说法中正确的是
A.反应①和②均为氧化还原反应
B.反应①中FeO Cr2O3是还原剂,在反应中失去电子。
C.反应②中Na2CrO4发生氧化反应
D.生成l mol的CO2,反应①转移3.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)26H2O]是一种浅绿色晶体,广泛应用于电镀工业。为探 究其分解产物,某学习小组利用如图所示装置进行实验。
(查阅资料)隔绝空气加热至500°C时,摩尔盐能完全分解,分解产物中有铁氧化物, 硫氧化物,氨气和水蒸气等。
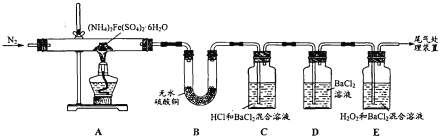
(1)对A装置加热前,先通一段时间N2的目的是_______。
(2)实验开始一段时间后,装置B中的现象为______。
(3)实验中观察到装置D始终无明显现象,装置C中和E中均产生白色沉淀。
①写出E中SO2与H2O2发生反应的化学方程式:_______。
②甲同学根据C中产生白色沉淀现象判断产物中一定含有SO3。请对甲同学的判断作出评价,并说明理由:_____。
(4)实验结束后,装置A中的固体变为红棕色,请补充完整检验该残留固体中是否含 FeO或Fe3O4的实验方案:取A中少量残留固体,加入稀硫酸使其完全溶解,向 溶液中滴加 ________,若观察到 ______,说明残留固体中不含FeO和Fe3O4。(提供的试剂有:NaOH溶液、氯水、硫氰化钾溶液、酸性高锰酸钾溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由CuO和KHC2O4溶液反应的到的蓝色结晶[KaCub(C2O4)cdH2O]。为测定其组成,进行了如下实验:
步骤1称取3.5400 g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100 mL溶液A.
步骤2量取20.00 mLA溶液,滴加0.2000 mol L-1 KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00 mL。
步骤3另取20.00 mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16 g。
己知:步骤2 中发生反应:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2↑ + 8H2O。
(1)步骤1中配制溶液A时,需要用到的玻璃仪器有烧杯、玻璃棒、_____。
(2)3.5400 g 该样品中含 n(C2O42-)= ____mol。
(3)3.5400 g 该样品中含 n(Cu2+)= ____mol。
(4)通过计算确定该蓝色晶体的化学式__________(计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中关于离子共存的说法正确的是( )
A.25℃时溶液中一定大量共存:Na+、Ca2+、Cl-、![]()
B.能与铝反应放出氢气的溶液中一定共存:Mg2+、Cu2+、![]() 、
、![]()
C.弱碱性溶液中可能大量共存:Na+、K+、Cl、![]()
D.0.1mol/LFeCl3溶液中可能大量共存:Fe2+、![]() 、SCN-、
、SCN-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com