
【题目】现有KNO3样品(含有少量杂质KCl、K2SO4),选择适当的试剂除去杂质,从而得到纯净的KNO3晶体,相应的实验流程如图所示。
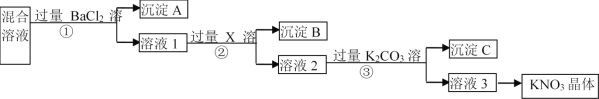
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X__,沉淀C__、__。
(2)上述实验流程中①②③步均要进行的实验操作是__(填操作名称)。
(3)生成沉淀A的离子方程式是__。
(4)此实验方案存在缺陷,还应__,之后若要获得纯净的KNO3晶体,需进行的实验操作是__、__(填操作名称)。
【答案】AgNO3 BaCO3 Ag2CO3 过滤 Ba2++SO42-=BaSO4↓ 向溶液3中加入适量的稀HNO3 蒸发浓缩 冷却结晶
【解析】
由流程可知,①中加氯化钡,硫酸根离子转化为沉淀,则沉淀A为![]() ,溶液1中含氯化钾、硝酸钾、氯化钡,②中加
,溶液1中含氯化钾、硝酸钾、氯化钡,②中加![]() 后氯离子转化沉淀,沉淀B为
后氯离子转化沉淀,沉淀B为![]() ,溶液2中含硝酸钾、硝酸银、硝酸钡,③中钡离子、银离子转化为沉淀,沉淀C为碳酸钡、碳酸银,溶液3为硝酸钾和碳酸钾,转化中试剂过量保证离子完全转化为沉淀,
,溶液2中含硝酸钾、硝酸银、硝酸钡,③中钡离子、银离子转化为沉淀,沉淀C为碳酸钡、碳酸银,溶液3为硝酸钾和碳酸钾,转化中试剂过量保证离子完全转化为沉淀,
(1)由上述分析可知,X为![]() ,沉淀C为碳酸钡、碳酸银,
,沉淀C为碳酸钡、碳酸银,
故答案为:![]() ;
;![]() ;
;![]() ;
;
(2)流程中①②③步均生成沉淀,需要进行过滤操作,
故答案为:过滤;
(3)①中加氯化钡,硫酸根离子转化为![]() 沉淀,离子方程式为:
沉淀,离子方程式为:![]() ,
,
故答案为:![]() ;
;
(4)溶液3中肯定含有![]() ,可加适量的稀硝酸后蒸发浓缩、冷却结晶得到纯净的硝酸钾,
,可加适量的稀硝酸后蒸发浓缩、冷却结晶得到纯净的硝酸钾,
故答案为:向溶液3中加入适量的稀![]() ; 蒸发浓缩;冷却结晶;
; 蒸发浓缩;冷却结晶;


科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

请回答下列问题
(1)写出下列物质的化学式A___,E___。
(2)F在空气中转化为G的化学方程式:__。
(3)A和B反应的化学方程式:___。
(4)H和I生成J的离子方程式:___。
(5)如何检验E中大量存在的阳离子?__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究实验室中制备Cl2的过程,为证明过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置,按要求回答问题:

(1)若用浓盐酸与足量的MnO2反应制Cl2。MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O。
①用双线桥表示该反应的电子转移___。
②___作氧化剂 ,___作还原产物。
(2)①装置B中盛放的试剂名称为___,作用是___。
②装置D和E中出现的不同现象说明的问题是___。
③写出装置G中发生反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意计算填空。
(1)在标准状况下,8.5g某气体占有的体积为5.6L,则该气体的摩尔质量是__。
(2)在标准状况下,0.01mol某气体的质量为0.28g,则该气体的相对分子质量为__,该气体的密度为__g·L1。
(3)在标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g,此混合物中CO和CO2物质的量之比是__,C和O原子个数比是__,CO的质量分数是__。
(4)现有mg某气体,它由双原子分子构成,它的相对分子质量为M。若阿伏伽德罗常数用NA表示,则:该气体的物质的量为__mol;该气体所含原子总数为__个;该气体在标准状况下的体积为__L;该气体溶于水后形成1L溶液(该气体不与水反应),其物质的量浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的内容:

(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL0.92mol·L-1的稀硫酸,现要配制该浓度的溶液所需的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__(填仪器名称);需要量取98%浓硫酸__mL进行配制;
(2)配制溶液时有如下操作:a.稀释溶解b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操作顺序正确的是(_____)
A.e→a→f→d→c→f→g→b B.e→a→d→f→c→f→g→b
C.e→a→f→d→c→f→b→g D.e→a→d→f→c→f→b→g
(3)在配制0.92mol·L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏低的是__;
A.未经冷却趁热将溶液注入容量瓶中 B.量取浓硫酸时仰视读数
C.定容时俯视观察液面 D.未洗涤烧杯和玻璃棒
(4)为中和100mL2.3mol·L-1KOH溶液使其恰好完全反应,需要加入__mL0.92mol·L-1稀硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从甲苯出发,按下面流程可以合成苯甲酸苯甲酯和水杨酸。
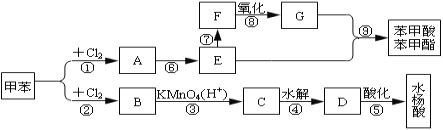
已知水杨酸的结构简式为![]() 且酚羟基易被氧化。请回答:
且酚羟基易被氧化。请回答:
(1)写出下列反应的条件:①_____________、②_______;
(2)C、F的结构简式分别为:C___、F___;
(3)写出反应⑥、⑨的化学方程式:⑥________________⑨_____
(4)写出反应类型:②____________ ⑥____________ ⑨______________
(5)③、④两步反应能否互换,为什么?___。
(6)写出水杨酸的同分异构体中属于酯的结构简式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,反应NH3(g)+HCl(g)=NH4Cl(s)能自发发生反应,则该反应的△H>0
B.常温下,等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C.常温下,0.1molL﹣1CH3COONa溶液加水稀释后,溶液中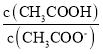 的值增大
的值增大
D.常温下,向BaCO3、BaSO4的饱和溶液中加入少量BaCl2固体,溶液中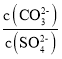 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
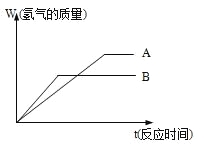
(1) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙
丙三组实验,三组实验各取500mL同浓度的盐酸
溶液加入该种混合粉末,产生气体,有关数据如下:
实验序号 | 甲 | 乙 | 丙 |
混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
生成气体气体(mL) | 2240 | 5600 | 5600 |
①乙组实验中,盐酸________(填“过量”、“适量”或“不足量”)
②上述所用的盐酸的物质的量浓度为_____mol/L,混合粉末的平均摩尔质量是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com