
【题目】如图所示甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
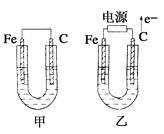
(1)若两池中电解质溶液均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②甲池中负极的电极反应式是____________________________________________。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式:______________________________________________。
②乙池碳棒上电极反应属于________(填“氧化反应”或“还原反应”)。
【答案】碳 铁 Fe-2e- =Fe2+ 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 氧化反应
Cl2↑+H2↑+2OH- 氧化反应
【解析】
(1)甲池为原电池,铁做负极,碳棒作正极,依据氧化还原反应的规律和原电池的工作原理作答;
(2)若电解质溶液为饱和氯化钠溶液,则依据电子的流动方向判断出Fe为阴极,C棒为阳极,再结合电解池的工作原理作答。
(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有红色的Cu析出,乙池为电解池,外电路电子流向电源正极,所以碳棒为阳极,放出氯气,阴极铁电极上发生还原反应有红色的Cu单质析出,故答案为:碳;铁;
②甲池中负极铁失电子生成Fe2+,其电极反应式为Fe-2e-=Fe2+;
(2)①若电解质溶液为饱和氯化钠溶液,则乙池为用惰性电极为阳极电解氯化钠溶液,方程式为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
②乙池碳棒为电解池的阳极,发生的是失电子的氧化反应,故答案为:氧化反应。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:
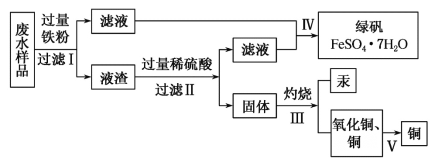
(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是__________设计简单实验检验绿矾是否变质,简述你的操作:__________。
(2)步骤Ⅰ中加入过量铁粉的目的是__________,步骤Ⅱ中__________(填“能”或“不能”)用盐酸代替硫酸。
(3)步骤V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。
从安全角度考虑,方案__________不好;从产品纯度考虑,方案__________不好。
(4)写出步骤Ⅱ中涉及反应的离子方程式:__________;步骤Ⅳ得到绿矾的操作蒸发浓缩__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼钛的有关反应如下所示:
① C(s) + O2(g) ![]() CO2(g) ΔH1
CO2(g) ΔH1
② 2CO(g) + O2(g) ![]() 2CO2(g) ΔH2
2CO2(g) ΔH2
③ TiO2(s) + 2Cl2(g) ![]() TiCl4(g) + O2(g) ΔH3
TiCl4(g) + O2(g) ΔH3
④ TiCl4(s) + 2Mg(s) ![]() 2MgCl2(s) + Ti(s) ΔH4
2MgCl2(s) + Ti(s) ΔH4
⑤ TiO2(s) + 2Cl2(g) + 2C(s) ![]() TiCl4(g) + 2CO(g) ΔH5
TiCl4(g) + 2CO(g) ΔH5
下列有关推断正确的是( )
A. 2ΔH1=ΔH2 B. ΔH1<0,ΔH2>0
C. ΔH5=ΔH3+2ΔH1-ΔH2 D. 2ΔH1-ΔH2>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置的叙述错误的是
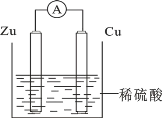
A. 锌是负极,其质量逐渐减小
B. 氢离子在铜表面得e-
C. 电子从锌片经导线流向铜片
D. 电流从锌片经导线流向铜片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的VL密闭容器中充入4molNH3和5molO2,发生如下反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)。请回答下列问题:
4NO(g)+6H2O(g)。请回答下列问题:
(1)下列能说明该反应已经达到平衡状态的是_______;
A 容器中气体总质量不变
B c(O2)不变
C v(O2)=1.25v(NH3)
D 体系压强不变
E 相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小。则速率逐渐增大是因为______,速率又逐渐减小的原因是_____。
(3)1mol NH3(g)在纯氧中完全燃烧生成无污染的气态物质,放出akJ的热量。写出该反应的热化学方程式__________________________________________。
(4)若将(3)所述反应设计为电解质溶液为KOH的原电池,则负极反应式 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学选3——物质结构与性质)利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________,其单电子数为_________________。
(2)C、N、O、Mn电负性由大到小的顺序是___________。
(3)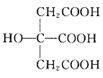 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______;该物质中不存在的作用力有_____。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
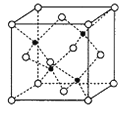
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,![]() 为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、W的原子序数依次增大, X的原子在周期表中半径最小,Y的次外层电子数是其最外层的![]() ,Z单质可与冷水缓慢反应产生X单质,W与 Y属于同一主族。下列叙述正确的是( )
,Z单质可与冷水缓慢反应产生X单质,W与 Y属于同一主族。下列叙述正确的是( )
A. 由Y元素形成的离子与 Z元素形成的离子的核外电子总数可能相同
B. 单质的氧化性:W>Y
C. 化合物X2Y、ZY、ZX2 中化学键的类型均相同
D. 原子半径:rw>rz>rY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g) ![]() 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g) ![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g) ![]() CH3 OH(g) △H3=-107 kJ. molˉ1
CH3 OH(g) △H3=-107 kJ. molˉ1
则CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=___________kJ·molˉ1,增大压强,CH3OH(g)的转化率___________(填“增大”“减小”或“不变”,下同),升高温度,CH3OH(g)的转化率___________。
CO2(g)+2H2O(g) △H=___________kJ·molˉ1,增大压强,CH3OH(g)的转化率___________(填“增大”“减小”或“不变”,下同),升高温度,CH3OH(g)的转化率___________。
(2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0 mol CO2和6.8molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=—50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率[α(CO2)]随时间的变化如图所示。
CH3OH(g)+H2O(g) △H=—50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率[α(CO2)]随时间的变化如图所示。
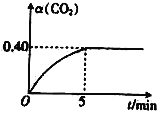
①在0~5min内A容器中v(CH3OH)=_______;该温度下上述反应的平衡常数K=_______(保留两位有效数字)。
②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A) ________(填“>”“<”或“=”)v(B)。
③下列各项指标能表明A容器中反应的v正>v逆的是___(填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.断裂H-H键的数目是形成C-O键数目的2倍
d.v逆(CO2)=v正(H2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com