
【题目】短周期元素 X、Y、Z、W的原子序数依次增大, X的原子在周期表中半径最小,Y的次外层电子数是其最外层的![]() ,Z单质可与冷水缓慢反应产生X单质,W与 Y属于同一主族。下列叙述正确的是( )
,Z单质可与冷水缓慢反应产生X单质,W与 Y属于同一主族。下列叙述正确的是( )
A. 由Y元素形成的离子与 Z元素形成的离子的核外电子总数可能相同
B. 单质的氧化性:W>Y
C. 化合物X2Y、ZY、ZX2 中化学键的类型均相同
D. 原子半径:rw>rz>rY
【答案】A
【解析】
短周期元素 X、Y、Z、W 的原子序数依次增大,X 的原子在周期表中半径最小,X为H元素;Y 的次外层电子数是其最外层的![]() ,Y有2个电子层符合电子排布规律,则最外层电子数为6,Y为O元素;Z 单质可与冷水缓慢反应产生 X 单质,Z为Na元素;W 与 Y 属于同一主族,W为S元素,以此来解答。
,Y有2个电子层符合电子排布规律,则最外层电子数为6,Y为O元素;Z 单质可与冷水缓慢反应产生 X 单质,Z为Na元素;W 与 Y 属于同一主族,W为S元素,以此来解答。
由上述分析可知,X为H、Y为O、Z为Na、W为S。
A.Y元素形成的离子与 Z元素形成的离子的核外电子总数分别为10、10,二者相同,A正确;
B.非金属性越强,该元素的单质的氧化性就越强,由于元素的非金属性O>S,所以氧化性:O2>S,B错误;
对应阴离子的还原性越弱,则阴离子的还原性:W>Y>X,故B正确;
C.化合物 X2Y是H2O,只含共价键,Z2Y是Na2O只含有离子键,ZX是NaH只含离子键,C错误;
D.同一周期从左下右原子半径减小,不同周期是元素,原子核外电子层数越多,原子半径越大,所以原子半径:rz>rw>rY,D错误;
故合理选项是A。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】用A+、B-、C2-、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是________、B元素是________、C元素是_______(用元素符号表示)。
(2)B的单质可用来制“84”消毒液的主要成分,写出反应的离子方程式________________。
(3)用文字描述比较B、C两元素的非金属性强弱的方法(必要时可用方程式,至少一条):___________________________________。
(4)D是由两种元素组成的双原子分子,用电子式表示其形成过程________________。
(5)E是所有含18个电子的微粒中氧化能力最强的分子,其与水反应的化学方程式为___________________。
(6)F分子中含有4个原子,既有极性键又有非极性键,其电子式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
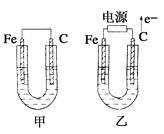
(1)若两池中电解质溶液均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②甲池中负极的电极反应式是____________________________________________。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式:______________________________________________。
②乙池碳棒上电极反应属于________(填“氧化反应”或“还原反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验,能达到实验目的的是
A | B | C | D |
|
|
|
|
验证化学能转化为电能 | 研究催化剂对化学反应速率的影响 | 实验室制氨气 | 验证非金属性:Cl>C>Si |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中加入2.0molSO2和1.0molO2,一定条件下发生如下反应2SO2+O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为( )
2SO3。反应达到平衡后,各物质的物质的量可能为( )
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 2.0 | 1.0 | 0 |
B | 1.0 | 0.8 | 1.0 |
C | 0.20 | 0.10 | 1.80 |
D | 0 | 0 | 2.0 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是
A. 在强碱性溶液中次氯酸钠与 Fe(OH)3 反应生成 Na2FeO4: 3ClO3-+2Fe(OH)3 =2FeO42-+3Cl-+H2 O+4H+
B. 用浓盐酸与 MnO2 反应制取少量氯气:MnO2+2H++2Cl-= Mn2++Cl2↑+2H2O
C. 向 NaAlO2 溶液中通入过量 CO2 制 Al(OH)3:AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-
D. 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-===3Fe3++NO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是
2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是
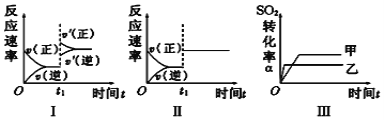
A. 图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C. 图Ⅲ表示的是温度对平衡的影响,且甲的温度小于乙的温度
D. 图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为 MnO2,还含有 Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和 Cu(0.86%)等元素的化合物,其处理流程图如下:
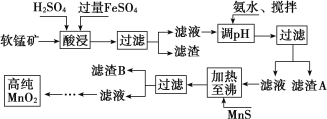
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp 近似值 | 10-34 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要离子反应方程式为:_____________ ;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能______________, 滤渣 A 的成分是 Fe(OH)3、Al(OH)3,加入氨水需调节 pH 至少达到_________________,恰好能使 Fe3+、Al3+沉淀完全(当 c≤10-5 mol·L-1 时,认为该离子沉淀完全);
(3)滤渣 B 的成分是 ________________
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:______________ 工业上采用间接氧化还原滴定法测定 MnO2 纯度,其操作过程如下:准确称量 0.920 0 g 该样品,与足量酸性 KI 溶液充分反应后,配制成 100 mL 溶液。取其中 10.00 mL,恰好与 25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2 +2S 2O32-===2I-+S 4O62-)。计算可得该样品纯度为_____%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
① 甲硅烷(SiH4)固态时属于___________晶体。
② 已知室温下1 g甲硅烷自燃生成SiO2和液态水放出热量44.6 kJ,则其热化学方程式为______________________。
(2)甲醇燃料电池的总反应为:2CH3OH+3O2═2CO2↑+4H2O,其工作原理如下图所示。
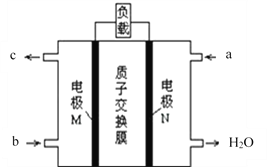
①图中CH3OH从_____________(填a或b)通入,该电池的正极是____________(填M或N)电极,其中在N极发生的电极反应式是_____________________。
②如果在外电路中有1mol电子转移,则消耗标准状况下O2的体积为_______L。
(3)25℃,101kPa条件下,14g N2和3g H2反应生成NH3的能量变化如下图所示:
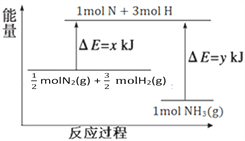
已知:① x = 1127;
② 25℃ 101kPa下,N2(g)+3H2(g)![]() 2NH3(g)△H=-92kJ·mol—1。
2NH3(g)△H=-92kJ·mol—1。
则 y =__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com