
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
① 甲硅烷(SiH4)固态时属于___________晶体。
② 已知室温下1 g甲硅烷自燃生成SiO2和液态水放出热量44.6 kJ,则其热化学方程式为______________________。
(2)甲醇燃料电池的总反应为:2CH3OH+3O2═2CO2↑+4H2O,其工作原理如下图所示。
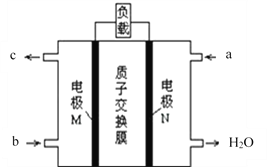
①图中CH3OH从_____________(填a或b)通入,该电池的正极是____________(填M或N)电极,其中在N极发生的电极反应式是_____________________。
②如果在外电路中有1mol电子转移,则消耗标准状况下O2的体积为_______L。
(3)25℃,101kPa条件下,14g N2和3g H2反应生成NH3的能量变化如下图所示:
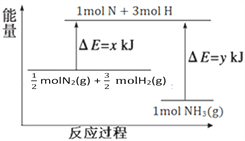
已知:① x = 1127;
② 25℃ 101kPa下,N2(g)+3H2(g)![]() 2NH3(g)△H=-92kJ·mol—1。
2NH3(g)△H=-92kJ·mol—1。
则 y =__________。
【答案】 分子 SiH4(g)+2O2(g)= SiO2(s)+2H2O(l) ΔH=-1427.2 kJ/mol b N 4H+ + O2 + 4e- = 2H2O 5.6L 1173
【解析】(1)①甲硅烷(SiH4)是由SiH4分子构成的共价化合物,在固态时属于分子晶体;②在室温下1 g甲硅烷即1/32mol,自燃生成SiO2和液态水放出44.6 kJ的热量,则其热化学方程式为SiH4(g)+2O2(g)= SiO2(s)+2H2O(l) ΔH=-1427.2 kJ/mol;
(2)根据反应方程式2CH3OH+3O2═2CO2↑+4H2O,结合原电池示意图可知CH3OH在负极反应,失去电子生成CO2,O2在正极反应,得到电子生成水,所以①CH3OH从b口通入,从c口排出CO2,O2从a口通入,电池的正极是N,负极是M,正极N上发生的电极反应为O2 +4H+ + 4e- = 2H2O;②若外电路有1mol电子转移,则消耗标况下O2的体积为![]() mol×22.4L/mol=5.6L;
mol×22.4L/mol=5.6L;
(3)根据图示的能量变化,可得![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g)△H= (x-y)kJ·mol-1,结合已知条件可得2(x-y)= - 92,x = 1127,解得y=1173。
NH3(g)△H= (x-y)kJ·mol-1,结合已知条件可得2(x-y)= - 92,x = 1127,解得y=1173。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是周期表前四周期的元素,原子序數依次增大。A的基态原子2p能级上有2个单电子;C是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一;D与F不同周期,但最外能层电子数相等。
(1)写出基态C原子的电子排布式: ____________。
(2)A、B、C三种元素第一电离能最大的是____________。(用元素符号表示),其原因是____________。
(3)B、C两元素形成的化合物B2C的分子空间构型为____________。与B2C互为等电子体的粒子的化学式为____________。(填一种)。
(4)D、E形成的一种离子化合物,在晶胞结构图中黑球表示E的位置,白球表示D的位置,已知该晶胞的边长为ncm,阿伏加德罗常数为NA,求晶胞的密度ρ=_______g/cm3(用含n、NA的计算式表示)。
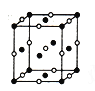
(5)由F原子形成的晶胞结构如图,F原子的半径为r,列式表示F原子在晶胞中的空间利用率:__________________(不要求计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡.其初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.该反应可表示为X+3Y2Z
B.反应达到平衡时,X的转化率为50%
C.前5min 以Y表示的平均反应速率为υ(Y)=0.01 molL﹣1min﹣1
D.增大压强使平衡向生成Z的方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应H2 + Cl2 ![]() 2HCl下列说法中正确的是
2HCl下列说法中正确的是
A. 该反应中,化学能只转变为热能
B. 反应物所具有的总能量高于产物所具有的总能量
C. 产物所具有的总能量高于反应物所具有的总能量
D. 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成2mol H-Cl键所放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示,下列说法正确的是
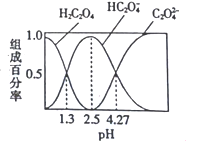
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反应HC2O4-+H2O![]() H2C2O4+OH-的平衡常数为10-4.27
H2C2O4+OH-的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物. 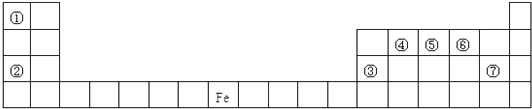
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)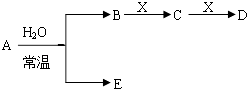
(1)若E为氧化物,则A与水反应的化学方程式为 , ①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为 ②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为
(2)若E为单质气体,D为白色沉淀,A的化学式可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
Ⅰ.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________。
Ⅱ.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

(2) “酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4生成1molPbSO4转移电子的物质的量为____________mol。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示:
NaHPbO2(aq),其溶解度曲线如图所示:

②粗品PbO中所含杂质不溶于NaOH溶液。
结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量__________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,___________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl2的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。

①阴极的电极反应式为_______________________。
②电解一段时间后,Na2PbCl4浓度极大减小,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置。其中结论正确的是( )
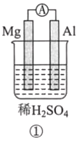
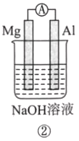
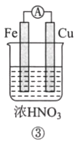
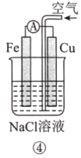
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,OH-向Al电极移动
C. ③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D. ④中Cu作正极,电极反应式为2Na++2e-=2Na
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com