
����Ŀ��̼�Ļ�������������������������Ҫ�����á�
��1����֪��2CO(g)+O2(g) ![]() 2CO2(g) ��H1=��566kJ��mol��1
2CO2(g) ��H1=��566kJ��mol��1
H2O(g)+CO(g) ![]() H2(g)+CO2(g) ��H2=��41kJ��mol��1
H2(g)+CO2(g) ��H2=��41kJ��mol��1
CO(g)+2H2(g) ![]() CH3 OH(g) ��H3=��107 kJ. mol��1
CH3 OH(g) ��H3=��107 kJ. mol��1
��CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) ��H=___________kJ��mol��1������ѹǿ��CH3OH(g)��ת����___________(��������������С����������������ͬ)�������¶ȣ�CH3OH(g)��ת����___________��
CO2(g)+2H2O(g) ��H=___________kJ��mol��1������ѹǿ��CH3OH(g)��ת����___________(��������������С����������������ͬ)�������¶ȣ�CH3OH(g)��ת����___________��
��2��T��ʱ�����ݻ���Ϊ2L��A��B�����ܱ������о�ͨ��4.0 mol CO2��6.8molH2��������Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=��50kJ��mol��1��A�����еķ�Ӧ�ں��¡����������½��У�B�����еķ�Ӧ�ں��¡���ѹ�����½��У����A������CO2��ת����[��(CO2)]��ʱ��ı仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H=��50kJ��mol��1��A�����еķ�Ӧ�ں��¡����������½��У�B�����еķ�Ӧ�ں��¡���ѹ�����½��У����A������CO2��ת����[��(CO2)]��ʱ��ı仯��ͼ��ʾ��
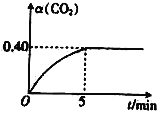
����0~5min��A������v(CH3OH)=_______�����¶���������Ӧ��ƽ�ⳣ��K=_______(������λ��Ч����)��
�ڷ�Ӧ��ʼ��ƽ��Ĺ����У�A��B��������CO2���������ʵĴ�С��ϵΪv(A) ________(����>����<������=��)v(B)��
�����и���ָ���ܱ���A�����з�Ӧ��v��>v������___(����)
a.��ϵ�ڵ�ѹǿ����
b.�����ƽ����Է�����������
c.����H��H������Ŀ���γ�C��O����Ŀ��2��
d.v��(CO2)=v��(H2)
���𰸡�-660 ��С ��С 0.16mol/(L��min) 0.53 �� ab
��������
(1)���ݸ�˹���ɣ�������![]() -����2-�۵ã�CH3OH(g)+
-����2-�۵ã�CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g)��ͬʱ�������H����ϻ�ѧƽ���Ӱ�����ط������
CO2(g)+2H2O(g)��ͬʱ�������H����ϻ�ѧƽ���Ӱ�����ط������
(2)�ٸ���ͼ����5minʱA�����еķ�Ӧ�ﵽƽ�⣬CO2��ת������(CO2)=40%���������ʽ������𣻢ڸ÷�ӦΪ���������С�ķ�Ӧ��A�����еķ�Ӧ�ں��¡����������½��У�B�����еķ�Ӧ�ں��¡���ѹ�����½��У���Ӧ�����������ѹǿA��B�����Ӱ�컯ѧ��Ӧ���ʵ����ط����жϣ���v(��)>v(��)��˵���ı�ij�����غ�ƽ�������ƶ����ݴ˷����жϡ�
(1)��2CO(g)+O2(g) ![]() 2CO2(g) ��H1=��566kJ��mol��1����H2O(g)+CO(g)
2CO2(g) ��H1=��566kJ��mol��1����H2O(g)+CO(g) ![]() H2(g)+CO2(g) ��H2=��41kJ��mol��1����CO(g)+2H2(g)
H2(g)+CO2(g) ��H2=��41kJ��mol��1����CO(g)+2H2(g) ![]() CH3 OH(g) ��H3=��107 kJ. mol��1�����ݸ�˹���ɣ�������
CH3 OH(g) ��H3=��107 kJ. mol��1�����ݸ�˹���ɣ�������![]() -����2-�۵ã�CH3OH(g)+
-����2-�۵ã�CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) ��H=(��566kJ��mol��1)��
CO2(g)+2H2O(g) ��H=(��566kJ��mol��1)��![]() -(��41kJ��mol��1)��2-(��107 kJ. mol��1)=-660kJ��mol��1������ѹǿ��ƽ�������ƶ���CH3OH(g)��ת���ʼ�С�������¶ȣ�ƽ�������ƶ���CH3OH(g)��ת���ʼ�С���ʴ�Ϊ�� -660����С����С��
-(��41kJ��mol��1)��2-(��107 kJ. mol��1)=-660kJ��mol��1������ѹǿ��ƽ�������ƶ���CH3OH(g)��ת���ʼ�С�������¶ȣ�ƽ�������ƶ���CH3OH(g)��ת���ʼ�С���ʴ�Ϊ�� -660����С����С��
(2)�ٸ���ͼ����5minʱA�����еķ�Ӧ�ﵽƽ�⣬CO2��ת������(CO2)=40%������Ӧ�Ķ�����̼Ϊ1.6mol��������CH3OH 1.6mol��v(CH3OH)=![]() =0.16mol/(L��min)�����¶��£�CO2(g)+3H2(g)
=0.16mol/(L��min)�����¶��£�CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)��Ӧ�ﵽƽ��ʱ��CO2��H2��CH3OH��H2O�����ʵ����ֱ�Ϊ2.4mol��2.0mol��1.6mol��1.6mol�����ʵ���Ũ�ȷֱ�Ϊ1.2mol/L��1.0mol/L��0.8mol/L��0.8mol/L��ƽ�ⳣ��K=
CH3OH(g)+H2O(g)��Ӧ�ﵽƽ��ʱ��CO2��H2��CH3OH��H2O�����ʵ����ֱ�Ϊ2.4mol��2.0mol��1.6mol��1.6mol�����ʵ���Ũ�ȷֱ�Ϊ1.2mol/L��1.0mol/L��0.8mol/L��0.8mol/L��ƽ�ⳣ��K=![]() =0.53���ʴ�Ϊ��0.16mol/(L��min)��0.53��
=0.53���ʴ�Ϊ��0.16mol/(L��min)��0.53��
�ڸ÷�ӦΪ���������С�ķ�Ӧ��A�����еķ�Ӧ�ں��¡����������½��У�B�����еķ�Ӧ�ں��¡���ѹ�����½��У�A�����з�Ӧ�����������ѹǿ��С��B�е�����ѹǿ���䣬��Ӧ��ʼ��ƽ��Ĺ����У�A��B��������CO2���������ʣ�v(A) ��v(B)���ʴ�Ϊ������
��a.��ϵ�ڵ�ѹǿ����ƽ�������ƶ���˵��v(��)>v(��)����ȷ��b.������������䣬�����ƽ����Է�����������˵�����ʵ�����С��˵��ƽ�������ƶ�����v(��)>v(��)����ȷ��c.����H��H������Ŀ���γ�C��O����Ŀ��2����˵��v(��)��v(��)������d.v��(CO2)= v��(H2)�� v��(CO2)=v��(H2)��
![]() v��(H2)����ƽ�������ƶ���v(��)��v(��)������ѡab��
v��(H2)����ƽ�������ƶ���v(��)��v(��)������ѡab��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�ס������ص缫���϶���������̼������ش��������⣺
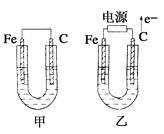
(1)�������е������Һ��ΪCuSO4��Һ����Ӧһ��ʱ���
���к�ɫ�����������Ǽ׳��е�________�����ҳ��е�________����
�ڼ׳��и����ĵ缫��Ӧʽ��____________________________________________��
(2)�������е������Һ��Ϊ����NaCl��Һ��
��д���ҳ����ܷ�Ӧ�����ӷ���ʽ��______________________________________________��
���ҳ�̼���ϵ缫��Ӧ����________(����������Ӧ��������ԭ��Ӧ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������д������·�Ӧ��2SO2(g)��O2(g) ![]() 2SO3(g) ��H��0������������һ����ֻ�ı�ijһ����ʱ�����з�������ȷ����
2SO3(g) ��H��0������������һ����ֻ�ı�ijһ����ʱ�����з�������ȷ����
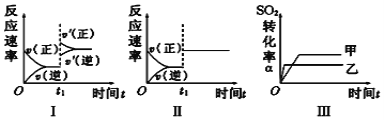
A. ͼ����ʾ����t1ʱ������ѹǿ�Է�Ӧ���ʵ�Ӱ��
B. ͼ����ʾ����t1ʱ�̼�������Է�Ӧ���ʵ�Ӱ��
C. ͼ����ʾ�����¶ȶ�ƽ���Ӱ�죬�Ҽ��¶�С���ҵ��¶�
D. ͼ����ʾ���Ǵ����Ի�ѧƽ���Ӱ�죬��ʹ���˴���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������п�̸ɵ�صĻ������ϣ���ҵ�������̿����̿�Ϊԭ�����Ʊ���ij���̿���Ҫ�ɷ�Ϊ MnO2�������� Si(16.27%)��Fe(5.86%)��Al(3.42%)��Zn(2.68%)�� Cu(0.86%)��Ԫ�صĻ�����䴦������ͼ���£�
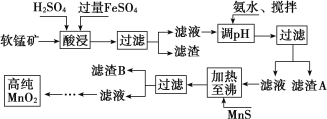
������ | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp ����ֵ | 10��34 | 10��16 | 10��38 |
(1)�������������������½� MnO2 ��ԭΪ MnSO4�����ʱ��������Ҫ���ӷ�Ӧ����ʽΪ��_____________ ��
(2)����ˮ���������������������������ܼӿ췴Ӧ���ʣ�����______________�� ���� A �ijɷ��� Fe(OH)3��Al(OH)3�����백ˮ����� pH ���ٴﵽ_________________��ǡ����ʹ Fe3����Al3��������ȫ(�� c��10��5 mol��L��1 ʱ����Ϊ�����ӳ�����ȫ)��
(3)���� B �ijɷ��� ________________
(4)MnO2 Ҳ���� MnSO4��H2SO4��H2O Ϊ��ϵ�ĵ��Һ�е���ã���������ӦʽΪ��______________ ��ҵ�ϲ��ü��������ԭ�ζ����ⶨ MnO2 ���ȣ�������������£�ȷ���� 0.920 0 g ����Ʒ������������ KI ��Һ��ַ�Ӧ�������Ƴ� 100 mL ��Һ��ȡ���� 10.00 mL��ǡ���� 25.00 mL 0.080 0 mol��L��1Na2S2O3��Һ��Ӧ(I2 ��2S 2O32-===2I-��S 4O62-)������ɵø���Ʒ����Ϊ_____%(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ղ�����β���к���һ������NO����ѧ���������һ�ּ�ӵ紦������ȥ����NO��װ�ã�����ͼ��ʾ�������Խ�NOת��ΪNH4+������˵����ȷ����
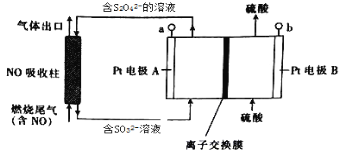
A. a���ӵ�Դ������
B. Pt�缫B�Ϸ����ĵ缫��ӦΪ2H2O��4e��=O2��+4H+
C. ��NO�������в���1mol SO32��ʱ�������ϴ�����NO��������Ϊ8.96L(��״��)
D. ͼ�е����ӽ���ĤӦΪ�����ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������п�������ϡH2SO4��Ӧ��ȡ������һ���¶���Ϊ������Ӧ���ʶ��ֲ�Ӱ����������������������м���(����)
A.CH3COOK����B.CuCl2����C.KNO3��ҺD.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������NaOH��Һ����μ���AlCl3��Һ�����ɳ���Al(OH)3������AlCl3�������ı仯��ϵ��ͼ��ʾ���������������ڶ�Ӧ����Һ��һ���ܴ����������(����)
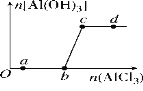
A. a���Ӧ����Һ�У�Na����Fe3����SO42-��HCO3-
B. b���Ӧ����Һ�У�Na����S2����SO42-��Cl��
C. c���Ӧ����Һ�У�Ag����Ca2����NO3-��F��
D. d���Ӧ����Һ�У�K����NH4+��I����CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�������������ᷢչ�Ļ������о���ѧ��Ӧ�е������仯�������ڸ��õ����û�ѧ��ӦΪ�������������
��1�����飨SiH4����һ����ɫ���壬���������ܷ�����ը����ȼ��
�� ���飨SiH4����̬ʱ����___________���塣
�� ��֪������1 g������ȼ����SiO2��Һ̬ˮ�ų�����44.6 kJ�������Ȼ�ѧ����ʽΪ______________________��
��2���״�ȼ�ϵ�ص��ܷ�ӦΪ��2CH3OH+3O2�T2CO2��+4H2O���乤��ԭ������ͼ��ʾ��
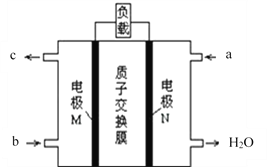
��ͼ��CH3OH��_____________����a��b��ͨ�룬�õ�ص�������____________����M��N���缫��������N�������ĵ缫��Ӧʽ��_____________________��
����������·����1mol����ת�ƣ������ı�״����O2�����Ϊ_______L��
��3��25�棬101kPa�����£�14g N2��3g H2��Ӧ����NH3�������仯����ͼ��ʾ��
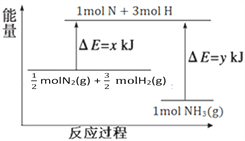
��֪���� x = 1127��
�� 25�� 101kPa�£�N2(g)+3H2(g)![]() 2NH3(g)��H=��92kJ��mol��1��
2NH3(g)��H=��92kJ��mol��1��
�� y =__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��(1)H2(g) +1/2O2(g)��H2O(g) ��H��-241.8 kJ/mol
(2)1/2N2 (g) + O2(g)��NO2(g) ��H����33.9 kJ/mol
(3)1/2N2 (g) +3/2 H2(g)��NH3(g) ��H��-46.0 kJ/mol
����NH3(g)ȼ������NO2(g)��H2O(g)��ȼ����
A��282.8 kJ/mol B��-282.8 kJ/mol C��848.4kJ/mol D��-848.4 kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com